
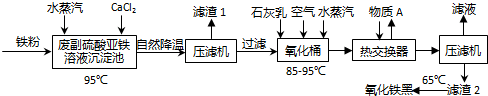
分析 废副产物硫酸亚铁溶液(含TiO2+离子)加铁屑、氯化钙、水蒸气加热,同时水蒸气还可以搅拌反应物,使反应物充分反应,铁粉与废液中的硫酸发生置换反应,与少量的铁离子发生化合反应,在加热条件下TiO2+水解生成Ti(OH)4,钙离子与硫酸根离子结合生成CaSO4•2H2O,都是复分解反应,过滤,滤渣为Ti(OH)4、CaSO4•2H2O,TiO2•xH2O,滤液主要含有FeCl2,滤液中通入空气同时加入石灰乳,再用水蒸气加热,亚铁离子部分被空气中氧气氧化成铁离子,通过压滤机得滤渣2主要为氢氧化亚铁和氢氧化铁的混合物,滤液中主要含有CaCl2可循环利用,滤渣2在65℃条件下加热可得氧化铁黑(Fe3O4),据此答题.
解答 解:硫酸亚铁溶液(含TiO2+离子)加铁屑、氯化钙、水蒸气加热,同时水蒸气还可以搅拌反应物,使反应物充分反应,在加热条件下TiO2+水解生成Ti(OH)4,钙离子与硫酸根离子结合生成CaSO4•2H2O,过滤,滤渣为Ti(OH)4、CaSO4•2H2O,TiO2•xH2O,滤液主要含有FeCl2,滤液中通入空气同时加入石灰乳,再用水蒸气加热,亚铁离子部分被空气中氧气氧化成铁离子,通过压滤机得滤渣2主要为氢氧化亚铁和氢氧化铁的混合物,滤液中主要含有CaCl2可循环利用,滤渣2在65℃条件下加热可得氧化铁黑(Fe3O4),
(1)根据上面的分析可知,沉淀池产生的滤渣除了Ti(OH)4外,主要成分是CaSO4•2H2O,沉淀池产生Ti(OH)4的离子方程式为 TiO2++3H2O=Ti(OH)4↓+2H+(或Fe+TiO2++3H2O=Ti(OH)4↓+Fe2++H2↑ ),
故答案为:CaSO4•2H2O; TiO2++3H2O=Ti(OH)4↓+2H+(或Fe+TiO2++3H2O=Ti(OH)4↓+Fe2++H2↑ );
(2)根据上面的分析可知,沉淀池中发生的反应有化合、置换、复分解,没有发生分解反应,故选C;
(3)氧化桶中发生的主要反应是生成氢氧化亚铁,然后空气中氧气将氢氧化亚铁氧化成氢氧化铁,反应的化学方程式为Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)由于Fe2+容易被氧化,所以氧化桶流出的滤液中Fe3+和Fe2+的比例略小于2:1,约为1.9:1,
故答案为:Fe2+容易被氧化,应使其比例略高;
(5)沉淀池、氧化桶中通入的水蒸气除了加热升温加快反应外,还可以搅拌反应物,使反应物充分反应,
故答案为:搅拌反应物,使反应物充分反应;
(6)滤液中主要含有CaCl2,最佳处理方式是循环至沉淀池继续使用,
故答案为:循环至沉淀池继续使用;
(7)根据上面的分析可知,流程中可在热交换器中预热的物质是水、FeCl2溶液,
故答案为:水、FeCl2溶液.
点评 本题考查了物质制备方案的设计方法,题目难度中等,明确制备原理及常见物质的性质为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:解答题
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
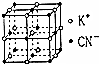 六氰合铁(Ⅲ)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、印染工业及钢铁工业均有重要作用,请回答下列问题:
六氰合铁(Ⅲ)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、印染工业及钢铁工业均有重要作用,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C3H6 | B. | C2H4和C2H6 | C. | CH4和C3H4 | D. | CH4和C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
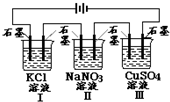 如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )
如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )| A. | 12、7、2 | B. | 13、7、1 | C. | 1、7、13 | D. | 7、13、1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
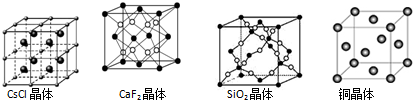
| A. | 在CsCl晶体中,距Cs+最近的Cl-有6个 | |
| B. | 在CaF2晶体中,Ca2+周围距离最近的F-有4个 | |
| C. | 在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子 | |
| D. | 在铜晶体中,每个铜原子周围距离最近的铜原子有12个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com