
(9分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
| 化学方程式 | K (T1 ) | K (T2) |
F2+H2  2HF 2HF | 1.8 × 1036 1036 | 1.9 ×1032 |
Cl2+H2  2HCl 2HCl | 9.7 ×1012 | 4.2 ×1011 |
Br2+H2  2HBr 2HBr | 5.6 ×107 | 9.3 ×106 |
I2+H2  2HI 2HI | 43 | 34 |
 态
态科目:高中化学 来源: 题型:阅读理解
| 温度 | 起始温度t1/℃ | 终止温度 t1/℃ |
温度差 (t2-t1)t1/℃ | ||
| 实验次数 | H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| C(H2)C(CO) |
| C(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 .已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为
.已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
(9分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
| 化学方程式 | K (T1 ) | K (T2) |
| F2+H2 | 1.8 ×1036 | 1.9 ×1032 |
| Cl2+H2 | 9.7 ×1012 | 4.2 ×1011 |
| Br2+H2 | 5.6 ×107 | 9.3 ×106 |
| I2+H2 | 43 | 34 |
(1)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a. 在相同条件下,X2的平衡转化率逐渐降低 b. X2与H2反应的剧烈程度逐渐减弱
c. HX的稳定性逐渐减弱 d. HX的还原性逐渐
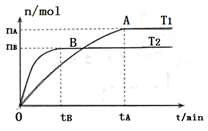
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=__________
②分析右图所示图像,下列说法正确的是________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(3)加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(4)在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式 、 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省济南市高三12月月考化学试卷 题型:填空题
(9分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
|
化学方程式 |
K (T1 ) |
K (T2) |
|
F2+H2 |
1.8 ×1036 |
1.9 ×1032 |
|
Cl2+H2 |
9.7 ×1012 |
4.2 ×1011 |
|
Br2+H2 |
5.6 ×107 |
9.3 ×106 |
|
I2+H2 |
43 |
34 |
(1)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a. 在相同条件下,X2的平衡转化率逐渐降低 b. X2与H2反应的剧烈程度逐渐减弱
c. HX的稳定性逐渐减弱 d. HX的还原性逐渐
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
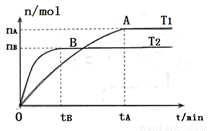
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=__________
②分析右图所示图像,下列说法正确的是________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(3)加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(4)在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com