
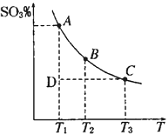
 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:分析 ①由图象可知反应混合体系SO3的百分含量随温度升高而减小,据此分析;若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通入大量氮气后,由于压强不变,容器的体积增大,反应物所占分压减小,则平衡向气体体积增大的方向移动;
②根据温度对平衡的影响分析K的大小;根据反应进行的程度分析.
解答 解:①由图象可知反应混合体系SO3的百分含量随温度升高而减小,即升高温度平衡逆向移动,所以正方向为放热反应,△H<0;若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通入大量氮气后,由于压强不变,容器的体积增大,反应物所占分压减小,则平衡向逆方向移动,
故答案为:<;向逆方向;
②由图象可知T1<T2,已知△H<0,所以升高温度平衡逆向移动,K减小,即K1>K2;由图象可知反应进行到D点时为达到平衡状态,所以反应向正方向进行,则V正>V逆;
故答案为:>;>.
点评 本题考查了平衡移动及影响因素,平衡常数的应用等,难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
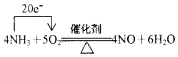 .若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为$\frac{22.4n}{5V}$(写出含字母的表达式).
.若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为$\frac{22.4n}{5V}$(写出含字母的表达式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 第一次加入 | Al | Na | Zn | Mg |
| 第二次加入 | K | Mg | Al | Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,该反应的反应类型为加成反应
,该反应的反应类型为加成反应 
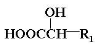 上的羟基可以氧化成羰基,再脱羧变成醛;
上的羟基可以氧化成羰基,再脱羧变成醛; (R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为
(R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为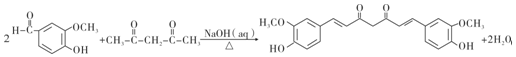
 可用于合成有机高分子色素,根据Claisen缩合反应,设计
可用于合成有机高分子色素,根据Claisen缩合反应,设计 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热 | |
| C. | 燃烧热和中和热是反应热的种类之一 | |
| D. | 在稀溶液中,1 mol乙酸和1 mol氢氧化钠完全中和时放出的热量为57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
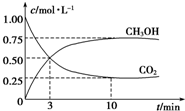 为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答下列问题:
为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com