
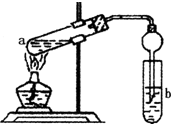
 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.分析 (1)a试管中乙醇和乙酸发生酯化反应生成乙酸乙酯和水;
(2)b中为碳酸钠溶液,与乙酸乙酯分层,且乙酸乙酯的密度比水的密度小;
(3)酯化反应为可逆反应,且浓硫酸吸收水,利用反应正向移动;
(4)饱和碳酸钠溶液可吸取乙醇、除去乙酸,降低乙酸乙酯的溶解度;
(5)球形干燥管除起冷凝作用外,可防止倒吸;
(6)先小火加热防止乙酸、乙醇挥发,改用大火加热根据反应为可逆反应及时蒸出生成的乙酸乙酯,使反应向右进行;
(7)乙酸乙酯和Na2CO3溶液分层.
解答 解:(1)醋酸和乙醇在浓硫酸催化作用下发生酯化反应,生成乙酸乙酯和水,反应的化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(2)b中为碳酸钠溶液,与乙酸乙酯分层,且乙酸乙酯的密度比水的密度小,试管b中观察到的主要现象是溶液分层、油状液体在上层,
故答案为:溶液分层、油状液体在上层;
(3)酯化反应为可逆反应,且浓硫酸吸收水,利用反应正向移动,则该反应为浓硫酸的作用为催化剂和吸水剂,
故答案为:催化剂和吸水剂;
(4)饱和碳酸钠溶液的作用为吸取乙醇、除去乙酸,降低乙酸乙酯的溶解度,偏于分层,
故答案为:吸取乙醇、除去乙酸,降低乙酸乙酯的溶解度;
(5)乙醇、乙酸易溶于水,则球形干燥管除起冷凝作用外,另一个重要作用是防止倒吸,
故答案为:防止倒吸;
(6)本实验反应开始时用小火加热,目的是加快反应速率,同时由于反应物乙酸、乙醇沸点较低,小火加热防止反应物为来得及反应而挥发损失,后改用大火加热,只因为反应为可逆反应,及时蒸出生成的乙酸乙酯,使反应向右进行.
故答案为:加快反应速率,同时防止反应物为来得及反应而挥发损失;蒸出生成的乙酸乙酯,使可逆反应向右进行;
(7)乙酸乙酯和Na2CO3溶液分层,分液法分离,主要仪器为分液漏斗,故答案为:分液;分液漏斗.
点评 本题考查有机物的制备实验,为高频考点,把握反应原理、实验装置的作用、混合物分离为解答的关键,侧重分析与实验能力的考查,注意(6)中平衡移动的应用,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
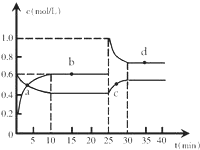 在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 表1 | 表2 | |||
| 物质 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
| Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
| Ni2+ | 6.7 | 9.5 | NiCO3 | KSP=9.60×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 65 | 249 | 199.6 |
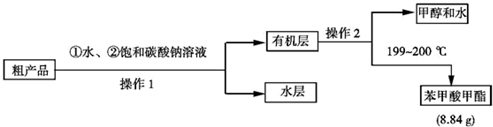
| 检验项目 | 实验现象及结论 |
| 检验粗产品中含有水的操作是 | |
| 检验粗产品中含有硫酸的操作是 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1 000 s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制90mL1.00mol/L的NaCl溶液,用托盘天平称取5.3gNaCl固体 | |
| B. | 使用容量瓶时,先检验其是否漏水,然后洗净后,不用干燥即可使用 | |
| C. | 可用10mL量筒量取8.58mL蒸馏水 | |
| D. | 在配制溶液定容后,上下翻转摇匀后发现液面下降,须加水至溶液凹液面与刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | |
| B. | 该样品中Cu、O元素的质量比为10:l | |
| C. | V=448 | |
| D. | 溶解样品时消耗H2SO4的物质的量为0.04 mo1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com