
硫代硫酸钠(Na2S2O3)俗称保险粉,可用作定影剂,也可用于纸浆漂白、脱氯剂等。
Na2S2O3易溶于水,不溶于乙醇,常温下溶液中析出晶体通常为Na2S2O·5H2O。实验室制备保险粉的装置如下图所示。涉及的总化学方程式如下: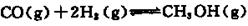

(1)检查虚线框内装置气密性的方法是 。
(2)反应前仪器a中加入的药品为 ,仪器c中加入的药品为 。
(3)仪器b的名称是 。
(4)在制备过程中,持续通人气体时,观察到B装置中先有大量浅黄色沉淀析出,反应一段时间,沉淀逐渐减少;待浅黄色沉淀消失时反应完成,停止加热。反应的离子方程式为 。
(5)反应完成后,为了从混合溶液中获取产品,操作如下:
操作②为 。
(6)为了测产品的纯度,称取8.000 g粗产品,配制成250 mL溶液,用移液管移取25.00 mL于锥形瓶中,再用0.05000 mol·L-l的碘标准溶液进行滴定(2S2O32-+I2=S4O62-+2I-),
平行3次实验,平均消耗碘标准溶液的体积为30.00mL。
①测得产品的纯度为 。
②关于上述实验的有关操作,以下表述正确的是 。(填编号)
| A.用碱式滴定管盛装碘标准溶液 |
| B.用移液管移取25.00mL溶液于锥形瓶中,移液管的尖嘴和锥形瓶内壁要接触 |
| C.如果滴定终点没有控制好,碘标准溶液滴加过量,则必须重新进行滴定 |
| D.滴定过程中若剧烈摇动锥形瓶(溶液不外溅),则所测得的纯度将会偏高 |
(1)关闭蒸馏烧瓶右端活塞,往分液漏斗中加水,打开分液漏斗的活塞,水开始下滴,一段时间后,如果水不再下滴,表明气密性良好。反之则气密性不好。
(2)Na2SO3固体 NaOH溶液(或KMnO4溶液等)
(3)三颈烧瓶
(4)S2O32-+SO2+H2O=S↓+2HSO32-
(5)蒸发浓缩、冷却结晶
(6)①93.00% ②B
解析试题分析:(1)检查虚线框内装置气密性的方法是关闭蒸馏烧瓶右端活塞,往分液漏斗中加水,打开分液漏斗的活塞,水开始下滴,一段时间后,如果水不再下滴,表明气密性良好。反之则气密性不好。(2)装置A是制取SO2的,反应前仪器a中加入的药品为Na2SO3固体,在分液漏斗内加入稀盐酸或稀硫酸。分数反应为:Na2SO3+H2SO4= Na2SO4+SO2↑+H2O;在装置B中加入Na2S。发生反应2Na2S+3SO2=2Na2SO3+3S ;Na2SO3+S=Na2S2O3。由于SO2或H2S都是大气污染物,所以未完全转化为Na2S2O3的SO2或H2S在装置C中被吸收。SO2或H2S都是酸性气体,同时也有还原性,所以仪器c中加入的药品为NaOH溶液(或KMnO4溶液等) 。(3)仪器b的名称是三颈烧瓶。(4)根据题意可得该反应的离子方程式为S2O32-+SO2+H2O=S↓+2HSO32-。(5)操作②从溶液中结晶析出晶体的操作是蒸发浓缩、冷却结晶。(6) ①由方程式2S2O32-+I2=S4O62-+2I-。可得n(Na2S2O3)=2n(I2)= 2×(0.05000 mol/L×0.03L)×(250 mL÷25.00 mL)=0.03mol.所以测得产品的纯度为(0.03mol×248g/mol)÷8.000g×100%="93.00%." ②A.碘单质有强的氧化性,容易腐蚀橡胶管,所以用酸式滴定管盛装碘标准溶液。错误。B.用移液管移取25.00mL溶液于锥形瓶中时,悬于移液管的尖嘴的液体是在量取体积范围内的,所以要和锥形瓶内壁要接触,使其滴入锥形瓶中。正确。C.测定样品的纯度就是以碘标准溶液为标准的,如果滴定终点没有控制好,碘标准溶液滴加过量,则可通过反滴加待测溶液。根据反应时二者的体积关系进行纯度的计算没有必须重新进行滴定。错误。D.滴定过程中若剧烈摇动锥形瓶,只要溶液不外溅,则二者就可以充分进行反应。所以对所测得的纯度无影响。错误。选项为B。
考点:考查装置气密性的检查、实验方案的设计、滴定法测定物质的纯度及实验误差分析的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:问答题
(15分)
水是生命之源,万物之基,是人类最宝贵的自然资源
(1)我国规定水质各种指标的主要要求为:a.不得呈现异色:b.不得有异味:C.水应澄清透明:d.不得含有细菌和病毒。前两项指标可以利用活性炭的____作用来实现:后两项指标可以通过加入消毒剂、絮凝剂反应、沉降,然后通过_____(填操作名称)来实现
(2)我国规定饮用水的硬度不超过25度硬度的表示方法是:将水中的 都看作
都看作 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的 和Mg2+可用一定浓度的Y溶液进行滴定,Y跟
和Mg2+可用一定浓度的Y溶液进行滴定,Y跟 都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
(3)某地下水的硬度是由Ca(HC03)2所引起的,下列方法中能够使之软化的是_____
A.将水加热煮沸 B.加入适量的Na3P04
C.加入过量的稀盐酸 D.将水通过磺化煤
(4)工业上采用硫化钠一石灰铁盐法除去含砷废水(砷的主要存在形式为H3ASO3的主要工艺
流程如下
已知:a.亚砷酸(H3As03)还原性较强,易被氧化为砷酸(H3AsO3)
B.亚砷酸盐的溶解性大于相应的砷酸盐
请回答以下问题:
①废气的主要成分为____
②写出一级沉砷过程中生成雌黄的离子方程式:______
③滤渣B的主要成分有_____〔写两种,用化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】
取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)上图C装置中球形干燥管的作用是_____________。
(2)完成以下实验步骤:组装好实验装置,首先____________,再加入实验药品。接下来的实验操作是______________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见___________。
【方案2】
用右图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是_____________。
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AIN的质量分数 。
【方案3】按以下步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为___________________。
(7)若在步骤③中未洗涤,测定结果将______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
生铁中含碳和硫等元素。化学兴趣小组对某生铁样品进行了探究。根据要求回答下列问题。
Ⅰ.生铁中碳和硫元素的定性检验
按如图装置进行实验(夹持仪器已略去,填接口字母代号)可以实现碳和硫元素的检验。
(1)仪器X的名称是 ;装置③⑤中试剂相同,装置④中盛放的试剂是 。(2)写出甲中反应的化学方程式 。(3)如果撤除装置③④⑤,能否确认生铁样品中碳元素的存在? ,理由是 。Ⅱ.生铁中碳、硫质量分数的测定
(4)甲同学认为,以上装置可以粗略测定样品中碳的含量。称取样品w1 g进行实验,充分反应后,测得装置⑥中生成的沉淀为w2 g,该样品中碳的质量分数为 (用含w1、w2的式子表示)。(5)乙同学认为,待一定量样品充分反应后,向装置④中加入过量氯化钡溶液,根据沉淀质量可以计算样品中硫的质量分数,此方案测得的结果 (填“偏大”或“偏小”);若要提高硫元素含量的测定精度,在不改变实验原理的前提下,可以采取的一种措施是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是 。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明 。
②称取Mg(NO3)2固体3.79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是 ;关闭K,用酒精灯加热时,正确操作是先 然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g⑤ 取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想 是正确的。
②根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应: (填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是 。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室制取乙酸丁酯的实验装置有如下图所示两种装置供选用。其有关物质的物理性质如下表: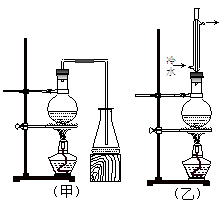
| | 乙酸 | 1-丁醇 | 乙酸丁酯 |
| 熔点(℃) | 16.6 | -89.5 | -73.5 |
| 沸点(℃) | 117.9 | 117 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
|


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室可用MnO2和KClO3混合加热的方法制取氧气:2KClO3 2KCl+3O2↑
2KCl+3O2↑
I.现有下列仪器或装置:
(1)A-D装置中,用作KClO3为原料制氧气的反应装置是____(填序号)。
(2)排水法收集氧气,接口顺序是:氧气出口→___→___→g→h→烧杯(填序号)。
Ⅱ.KClO3分解时尚有副反应,导致收集到的气体有异味。据推测,副产物可能是O3、Cl2、ClO2中的一种或几种。资料表明:O3、Cl2、ClO2的沸点依次为-111℃、-34℃和11℃,且O3、ClO2也能将KI氧化为I2。为探究副反应气体产物的成分,将KClO3分解产生的气体经干燥后通入如右装置进行实验:
(3)若要确认副产物中含Cl2,F中应盛放_____溶液。
(4)确定副产物中含有ClO2的现象是_________________。
(5)实验时若D中无现象,E中试纸变蓝,能否得出副产物含有臭氧的结论?
答:_____ (填“能”或“不能”)。理由是________________________________。
Ⅲ.ClO2是饮用水消毒剂。用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2-。为测定此饮用水中两者成分,进行如下实验:准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I- =I2+2ClO2-,反应结束后产生amolI2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I- =2I2+Cl-+2H2O,反应结束后叉产生bmolI2。
(6)饮用水中c(ClO2-)=_____________mol·L- 1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
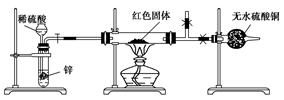
单质铜及其化合物一般都具有特殊的颜色,如
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4·5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com