
下面是一些实验室制备硫酸铜的实验设计。
实验一:用铜与浓硫酸反应制取硫酸铜。
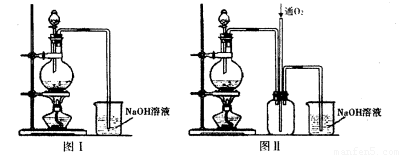
实验二:将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全制取硫酸铜。(装置如下图中的图I.图Ⅱ)。
实验三:将铜粉在某仪器中反复灼烧,使铜粉充分与空气发生反应生成氧化铜,再将氧化铜与稀硫酸反应,经后续步骤可得到硫酸铜晶体。
实验四:向铜粉和稀硫酸的混合物中加入H2O得到硫酸铜。
请回答实验中的有关问题。
(1)实验一中发生反应的化学反应方程式为____,这种方法的缺点是____。
(2)实验二装置图中分液漏斗里盛装的液体是____。图Ⅱ是图I的改进装置,分析图II装置的优点是 。
(3)实验三中用于灼烧的仪器名称是 。该实验中的后续步骤指的是__ 。
(4)实验四中发生反应的化学方程式为____。
(5)除上面的实验设计外,请你再设计一种只用铜和稀硫酸为原料制取硫酸铜的方法(写出化学反应方程式)。
(1)Cu+H2SO4(浓) CuSO4+SO2↑+H2O(2分) 生成物对环境造成污染(1分)
CuSO4+SO2↑+H2O(2分) 生成物对环境造成污染(1分)
(2)浓硝酸(1分)①有利于氮氧化合物的吸收(1分)②防止倒吸(1分)
(3)坩埚(1分)蒸发浓缩、冷却结晶、过滤、洗涤、干燥(只要答出蒸发、结晶、过滤即给分,2分)
(4)Cu+H2O2+H2SO4=CuSO4+H2O(2分)
(5)Cu+H2SO4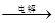 CuSO4+H2↑(2分,没有电解条件不给分)
CuSO4+H2↑(2分,没有电解条件不给分)
【解析】
试题分析:实验二中加入浓硝酸是提供H+,让硫酸根离子全部参与氧化还原反应。一般条件下,铜与稀硫酸不反应,必须在外加电场的作用下让其反应。所以得设计一个电解池来完成。
考点:有关硫酸的相关知识。考查电解的应用。


科目:高中化学 来源: 题型:阅读理解
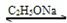 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH| 回流 |
| 振荡② |
| 回收有机液体③ |
| 加入乙酸乙酯④ |
| 乙酸酸化⑤ |
| ⑥ |
| ⑦ |
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |
| 无水硫酸钠 |
| 过滤 |
| 水浴蒸馏 |
| 减压蒸馏 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三上学期期末理综化学试卷(解析版) 题型:实验题
乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45 °C,沸点:180.8℃,它是有机合成中常用的原料。在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为:2CH3COOC2H5  CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:

阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题。
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 |
密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
沸点(℃) | 881.4 | 80 | 111 | 138. 4 | 76.8 |
最好选用??????? 来熔化钠。是否能用四氯化碳??? (填“是”或“否”)理由是??????????? 。
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管。缓缓加热,保持瓶中混合液微沸状态。在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是?????????????? 。烧瓶配上长导管的作用是????????????????? ,导管上端接一干燥管的目的是??????????????????????? 。
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是??????????????? ,写出步骤⑦实验操作的主要仪器???????? (填最主要一种)。
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品。

(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是??????????? 。
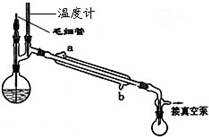
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示。冷凝管的进出水方向应????? 口进,????? 口出。毛细管的作用是???????? 。

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45°C,沸点:180.8℃,它是有机合成中常用的原料.在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为:
2CH3COOC2H5 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH
反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙酸钠.乙酰乙酸乙酯制备的流程如下:
金属钠,有机液体 钠熔化
钠熔化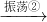 小米状钠珠
小米状钠珠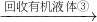
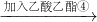 橘红色溶液
橘红色溶液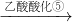 含乙酰乙酸乙酯的混合物
含乙酰乙酸乙酯的混合物 乙酰乙酸乙酯粗产品
乙酰乙酸乙酯粗产品
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题.
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |
最好选用______来熔化钠.是否能用四氯化碳?______(填“是”或“否”)
理由是______.
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管.缓缓加热,保持瓶中混合液微沸状态.在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是______,
烧瓶配上长导管的作用是______,导管上端接一干燥管的目的是______.
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是______,写出步骤⑦实验操作的主要仪器______(填最主要一种).
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品.
粗产品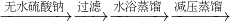 乙酰乙酸乙酯
乙酰乙酸乙酯
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是______.
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示.
冷凝管的进出水方向应______口进,______口出.毛细管的作用是______.
(6)实验最后所得产品远少于完全转化的理论产值,除了反应过程中的损耗外,主要原因是______.
查看答案和解析>>
科目:高中化学 来源:下城区模拟 题型:填空题

| 回流 |
| 振荡② |
| 回收有机液体③ |
| 加入乙酸乙酯④ |
| 乙酸酸化⑤ |
| ⑥ |
| ⑦ |
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |

| 无水硫酸钠 |
| 过滤 |
| 水浴蒸馏 |
| 减压蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com