
分析 (1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来解答;
(2)碱性溶液盛放在碱式滴定管中;
(3)滴定时,两眼注视锥形瓶中溶液颜色的变化;
(4)酚酞的变色范围是8-10,酸性溶液中酚酞为无色,碱性溶液中酚酞为红色,据此解答;
(5)根据实验操作对c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$的影响分析产生的误差.
解答 解:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以将准确称取的4.3g烧碱样品配成250mL待测液,还需要的主要仪器250mL容量瓶、胶头滴管,
故答案为:250mL容量瓶、胶头滴管;
(2)待测液是碱性溶液,应盛放在碱式滴定管中,
故答案为:碱;
(3)滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;
故答案为:锥形瓶中溶液颜色的变化;
(4)氢氧化钠的溶液显碱性,滴加酚酞变红色,用盐酸滴定时,溶液中的氢氧根离子逐渐减少,当氢离子与氢氧根离子完全反应生成水时,PH=7,所以溶液的颜色由红色逐渐变化为无色
故答案为:由红色变为无色;
(5)①读数:滴定前平视,滴定后俯视,导致标准液的体积偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知C(待测)偏小,
故答案为:偏小;
②未用标准液润洗滴定管,则滴定管中含有少量蒸馏水,标准溶液的浓度偏小,滴定时消耗的标准液的体积偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知C(待测)偏大,
故答案为:偏大;
③不小心将标准液滴在锥形瓶外面,滴定时消耗的标准液的体积偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知C(待测)偏大,
故答案为:偏大;
④滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁,则待测液的物质的量不变,消耗的标准液的体积不变,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知C(待测)不变,
故答案为:无影响.
点评 本题考查了酸碱中和滴定操作及误差分析,题目难度中等,注意掌握中和滴定的操作方法、滴定终点的判断方法、滴定误差的分析方法与技巧,试题有利于培养学生灵活应用所学知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 131I 原子的中子数为78 | B. | 131I 与127I互为同素异形体 | ||
| C. | 核裂变是一种化学变化 | D. | 碘在周期表中位于第四周期ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
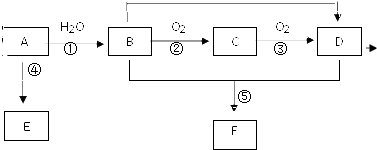 已知 A 的产量通常用来衡量一个国家的石油化工水平,现以 A 为主要原料合成高分子化合物 E 和一种具有果香味的物质 F,其合成路线如图所示.
已知 A 的产量通常用来衡量一个国家的石油化工水平,现以 A 为主要原料合成高分子化合物 E 和一种具有果香味的物质 F,其合成路线如图所示.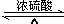 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
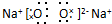 ,甲中的化学键类型为离子键、共价键.
,甲中的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$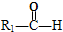 +
+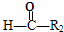 ,
,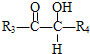 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$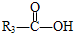 +
+
 .
. .
.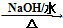 HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO
HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO 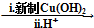 HCOOH
HCOOH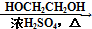 HCOOCH2CH2OOCH(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)
HCOOCH2CH2OOCH(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
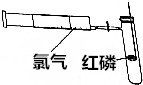 已知SnCl4、SiCl4、AlCl3、PCl3、PCl5等氯化物在潮湿的空气中都有白雾生成.为清楚地观察磷在氯气中燃烧,达到PCl3和PCl5分步生成的目的,可预先把干燥的氯气贮存在100mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后组成如图所示的装置.
已知SnCl4、SiCl4、AlCl3、PCl3、PCl5等氯化物在潮湿的空气中都有白雾生成.为清楚地观察磷在氯气中燃烧,达到PCl3和PCl5分步生成的目的,可预先把干燥的氯气贮存在100mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后组成如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
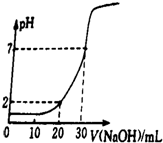 室温下:
室温下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com