
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,将相同的铝片分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加Na2S溶液可以得到Ag2S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.HClO光照分解生成HCl;
B.常温下,铝遇浓硝酸发生钝化;
C.氨气中含氢键;
D.AgCl沉淀中滴加Na2S溶液,发生沉淀的转化.
解答 解:A.HClO光照分解生成HCl,则弱酸可以制取强酸,但一般为较强酸可以制取较弱酸,故A错误;
B.常温下,铝遇浓硝酸发生钝化,则常温下,相同的铝片中分别加入足量的浓、稀硝酸,稀硝酸中铝片先溶解完,但一般为反应物浓度越大,反应速率越快,故B错误;
C.氨气中含氢键,沸点高于PH3,对不含氢键的,且结构和组成相似的物质,沸点随相对分子质量增大而升高,故C错误;
D.AgCl沉淀中滴加Na2S溶液,发生沉淀的转化,溶解度小的沉淀易向溶解度更小的沉淀转化,从而生成Ag2S更难溶的沉淀,故D正确;
故选D.
点评 本题考查了常见化合物的性质、元素非金属性强弱的判断依据、氢键对物质沸点的影响、浓硝酸、浓硫酸的性质,注意铁与浓硝酸在常温下发生钝化,题目难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
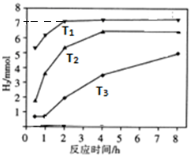 天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去.
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去.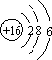 ;羰基硫分子的电子式为
;羰基硫分子的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向煮沸的1mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| B. | 用氢氧化铜粉末检验尿糖 | |
| C. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| D. | 用醋和澄清石灰水验证蛋壳中含有碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
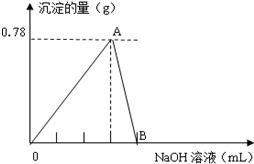
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是700 mL | |
| B. | 该合金中铜与镁的物质的量之比是2:1 | |
| C. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3与硫酸反应的实验中,实验室没有硫酸,临时用硝酸进行实验 | |
| B. | 滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 | |
| C. | 制取氯气时,用二氧化锰与浓盐酸在加热下反应,并用排水集气法收集 | |
| D. | 配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,用水稀释到所需浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com