��������1��Alԭ�Ӻ��������Ϊ13����3�����Ӳ㣬���������Ϊ2��8��3���ݴ���д�ṹʾ��ͼ��
��������������Һ��Ӧ����ƫ���������������ݴ���д��
��2��������������ᷴӦ�����ķ������һ����Σ������Ϊ����泥��ݴ���д��
��3���ٸ���n=
������5.60gSi
3N
4�����ʵ��������ݷ���ʽ����μӷ�Ӧ�����������ʵ���������v=
����v��H
2����
�ڸ��ݷ���ʽ����μӷ�Ӧ�ĵ��������ʵ���������ƽ��ʱ���������ʵ���������c=
���㵪����ƽ��Ũ�ȣ�
�۸��ݷ���ʽ����μӷ�Ӧ��SiCl
4��g�����ʵ���������ת���ʶ������SiCl
4��ת���ʣ�
�ܰ�n��SiCl
4����n��N
2����n��H
2��=3��2��6��Ͷ����ȣ���������������������ϣ���ЧΪ����ѹǿ���÷�Ӧ����Ӧ�������������ķ�Ӧ������ѹǿ��ƽ�����淴Ӧ�ƶ����ݴ��жϣ�
�ݸ��ݻ�ѧƽ����ƶ�������
���
�⣺��1��AlΪ13��Ԫ�أ�����������Ϊ13��3�����Ӳ㣬�ֱ�Ϊ2��8��3�ṹ����ԭ�ӽṹʾ��ͼΪ
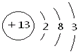
��Al�������ᷴӦ��������ǿ�Ӧ������NaOH��Һ��Ӧ�ķ���ʽΪ��2Al+2NaOH+H
2O=2NaAlO
2+3H
2�������ӷ���ʽΪ��2Al+2OH
-+H
2O=2AlO
2-+3H
2����
�ʴ�Ϊ��

��2Al+2OH
-+H
2O=2AlO
2-+3H
2����
��2��������������ᷴӦ�����ķ������һ����Σ�����ԭ���غ���֪�������Ϊ����泥���Ӧ����ʽΪ��Si
3N
4+16HF=4NH
4F+3SiF
4��
�ʴ�Ϊ��Si
3N
4+16HF=4NH
4F+3SiF
4��
��3��5.60gSi
3N
4�����ʵ�����n=
=
=0.04mol��
3SiCl
4��g��+2N
2��g��+6H
2��g��
Si
3N
4��s��+12HCl��g����H��0
3mol 2mol 6mol 1mol
0.12mol 0.08mol 0.24mol 0.04mol
�ٸ��ݷ���ʽ��֪�μӷ�Ӧ�����������ʵ���Ϊ0.04mol��6=0.24mol�����������ʵ���Ũ�ȱ仯��C��H
2��=
=
=0.12mol/L��H
2��ƽ����Ӧ����V=
=
=0.024mol/��L?min����
�ʴ�Ϊ��0.024��
�ڸ��ݷ���ʽ��֪��ƽ��ʱ���μӷ�Ӧ�ĵ��������ʵ���Ϊ0.04mol��2=0.08mol��ƽ��ʱ���������ʵ���0.2mol-0.08mol=0.12mol���ʵ�����ƽ��Ũ�ȣ�C=
=
=0.06mol/L��
�ʴ�Ϊ��0.06��
�۸��ݷ���ʽ��֪�μӷ�Ӧ��SiCl
4��g�����ʵ���Ϊ0.04mol��3=0.12mol����SiCl
4��ת����Ϊ
��100%=
��100%=40%��
�ʴ�Ϊ��40%��
�ܰ�n��SiCl
4����n��N
2����n��H
2��=3��2��6��Ͷ����ȣ���������������������ϣ���ԭƽ��Ͷ�������ͬ����ЧΪ����ѹǿ���÷�Ӧ����Ӧ�������������ķ�Ӧ������ѹǿ��ƽ�����淴Ӧ�ƶ���SiCl
4��g����ת���ʼ�С��
�ʴ�Ϊ����С��
�ݹ�ҵ���Ʊ����跴Ӧ���Ȼ�ѧ����ʽ���£�SiCl
4��g��+2H
2��g���TSi��s��+4HCl��g������H=+QkJ?mol
-1��Q��0����ij�¶ȡ�ѹǿ�£���һ�����ķ�Ӧ��ͨ���ܱ������������ϵķ�Ӧ����������Ϊ���淴Ӧ����
A����Ӧ�����У�������ѹǿ��ƽ�����㷴Ӧ�����ƶ���SiCl
4��ת���ʽ��ͣ���A����
B������Ӧ��ʼʱSiCl
4Ϊ1mol����Ϊ���淴Ӧ����ﵽƽ��ʱ����Ӧ��SiCl
4ӦС��1mol������������ӦС��QkJ����B����
C��SiCl
4��g��+2H
2��g���TSi��s��+4HCl��g������H=+QkJ?mol
-1��Q��0��
4mol QkJ
0.1mol 0.025QkJ
����Ӧ��������Ϊ0.025QkJʱ�����ɵ�HClΪ0.1mol��ͨ��100mL1mol?L
-1��NaOHǡ�÷�Ӧ����C��ȷ��
D��SiCl
4��g��+2H
2��g���TSi��s��+4HCl��g������H=+QkJ?mol
-1��Q��0��
0.06mol?L
-1 0.12mol?L
-1 ��Ӧ��4minʱ����HCl��Ũ��Ϊ0.12mol?L
-1����Ӧ��H
2��Ũ��Ϊ��0.06mol?L
-1�������ķ�Ӧ����V��H
2��=
=
=0.015mol/��L?min������D����
�ʴ�Ϊ��C��

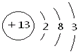 ��Al�������ᷴӦ��������ǿ�Ӧ������NaOH��Һ��Ӧ�ķ���ʽΪ��2Al+2NaOH+H2O=2NaAlO2+3H2�������ӷ���ʽΪ��2Al+2OH-+H2O=2AlO2-+3H2����
��Al�������ᷴӦ��������ǿ�Ӧ������NaOH��Һ��Ӧ�ķ���ʽΪ��2Al+2NaOH+H2O=2NaAlO2+3H2�������ӷ���ʽΪ��2Al+2OH-+H2O=2AlO2-+3H2���� ��2Al+2OH-+H2O=2AlO2-+3H2����
��2Al+2OH-+H2O=2AlO2-+3H2���� 


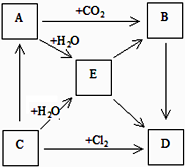 ��ͼ��ʾA��B��C��D��E�������ʵ��ת����ϵ������AΪ����ɫ���壬CΪ�������ʣ�DΪ��õĵ�ζƷ��
��ͼ��ʾA��B��C��D��E�������ʵ��ת����ϵ������AΪ����ɫ���壬CΪ�������ʣ�DΪ��õĵ�ζƷ�� ��1����������ͭ������ʹ�ù㷺�����ֽ�����
��1����������ͭ������ʹ�ù㷺�����ֽ�����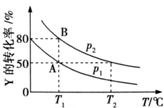 ��һ�̶��ݻ����ܱ������м���X��Y��Z�������壬����һ���¶ȣ���ͬʱ�̲��X��Y��Z�������ʵ����ʵ��������ʾ��
��һ�̶��ݻ����ܱ������м���X��Y��Z�������壬����һ���¶ȣ���ͬʱ�̲��X��Y��Z�������ʵ����ʵ��������ʾ��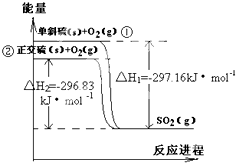 ��б���������ת��Ϊ��������� �����仯ͼ��ͼ���ش��������⣺
��б���������ת��Ϊ��������� �����仯ͼ��ͼ���ش��������⣺