
【题目】现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )

A. 离子半径:Y<Z
B. 氢化物的沸点:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池,其工作原理如图所示。
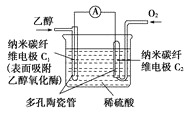
已知C1极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+,下列有关说法不正确的是( )
A. C1极为电池负极,C2极为电池正极
B. 电子由C2极经外电路导线流向C1极
C. C2极的电极反应式为O2+4H++4e-=2H2O
D. 该生物燃料电池的总反应式为:C2H5OH+3O2=2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢钠用途广泛。可广泛应用于医疗、生活、生产中。回答下列问题:
(1)碳酸氢钠能中和胃酸,碳酸氢钠属于____________(填“酸”“碱”“盐”)
(2)碳酸氢钠能与酒石酸配制固体清凉饮料的发泡剂。将发泡剂溶于水发生反应的离子是_________________。
(3)生活中可用碳酸氢钠蒸馒头,用化学方程式解释其原理__________。将碳酸氢钠加入面团中,若理论上生成二氧化碳0.1mol,需要碳酸氢钠的质量是_______克。
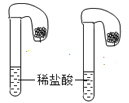
(4)碳酸钠和碳酸氢钠是厨房中常见用品,为鉴别它们,取等质量的样品分别加入如图所示装置的气囊中做对比实验,依据_____________现象,推断哪种样品为碳酸氢钠;写出该反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术。
(1)实验室制取Fe(OH)3胶体的操作是往____(填序号)中逐滴加入___(填序号),继续煮沸至出现红褐色即停止加热。
①沸水 ②NaOH溶液 ③饱和FeCl3溶液
(2)相应的化学方程式是____。
(3)向Fe(OH)3胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是___。
(4)除去胶体中混有的FeCl3和HCl的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如下。
实验1 |
|
实验2 |
|
下列分析正确的是( )
A. 实验1中,白色沉淀a是Al2(CO3)3
B. 实验2中,白色沉淀b一定是Al2(OH)2(CO3)2
C. 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
D. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国学者研制了一种纳米反应器,用于催化草酸二甲醋(DMO)和氢气反应获得EG。反应过程示意图如下。

下列说法正确的是
A.氢气在该反应中作为催化剂
B.DMO分子中只有碳氧单键发生了断裂
C.MG酸性水解的一种产物在一定条件下能形成高分子化合物
D.EG和甲醇互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某实验小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
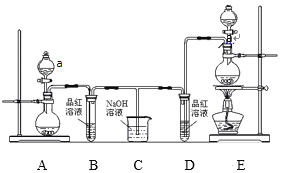
(1)仪器a的名称是 _________。
(2)利用图中E装置进行实验室制备Cl2的离子方程式是_________。
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是_______________。
(4)装置C的作用是_____________。
II.该小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。
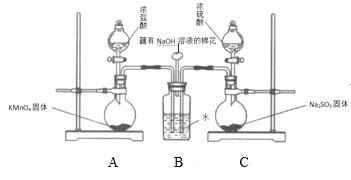
其中装置A制取氯气,装置C制取SO2:
(1)甲同学认为若SO2和Cl2反应,则应有Cl-生成,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量_________溶液,有白色沉淀生成。
(2)乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有的试剂是_________。
(3)丙同学认为按乙同学的建议改进实验也不合理,理由是:___________。
(4)丙同学取BaCl2溶液于试管中,加入少量反应后B中的溶液,生成大量白色沉淀,得出正确结论:SO2与Cl2同时通入水中能相互发生反应,反应的化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过石油的裂化和裂解可以得到“工业三烯”即乙烯、丙烯、1,3-丁二烯等,最近有科学家发现正丁烷(![]() )脱氢或不完全氧化也可制得1,3-丁二烯(
)脱氢或不完全氧化也可制得1,3-丁二烯(![]() ),已知热化学方程式如下:
),已知热化学方程式如下:
①![]()
![]()
![]()
②![]() =
=![]()
![]()
③![]()
![]()
下列说法正确的是
A.由②可知,正丁烷(![]() )的燃烧热为
)的燃烧热为![]()
B.由①和②可知,同质量的正丁烷(![]() )转变为1,3-丁二烯(
)转变为1,3-丁二烯(![]() )所需要的能量相同
)所需要的能量相同
C. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)-
Ba(OH)2(aq)-![]() BaSO4(s)+H2O(l)
BaSO4(s)+H2O(l) ![]()
D.由①和②可推知:![]() =
=![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计出燃料电池使汽油(设其成分为C5H12)氧化直接产生电流是21世纪最富有挑战性的课题之一。最近有人设计了一种固体燃料电池,固体氧化铝——氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如右图所示,其中多孔电极a、b均不参与电极反应。下列判断不正确的是
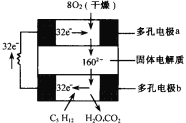
A.有O2放电的a极为电池的负极
B.b极对应的电极反应式为:C5H12+16O2--32e-=5CO2+6H2O
C.该电池的总反应方程式为:C5H12+8O2=5CO2+6H2O
D.汽油燃料电池最大的技术障碍是氧化反应不完全,产生炭粒堵塞电极的气体通道,从而使输电效能减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com