
| A. | 15mol 20% | B. | 20mol 20% | C. | 20mol 80% | D. | 40mol 80% |
分析 恒温恒容下,若开始只充入NH3,欲达到平衡时的各成份的百分含量与原平衡时相同,二者为等效平衡,由于反应前后气体的化学计量数之和不相等,故平衡时对应组分的物质的量相等,根据极限法计算氨气的物质的量,根据方程式计算原平衡时氨气的物质的量,进而计算开始只充入NH3时氨气的转化率.
解答 解:恒温恒容下,若开始只充入NH3,欲达到平衡时的各成份的百分含量与原平衡时相同,二者为等效平衡,由于反应前后气体的化学计量数之和不相等,故平衡时对应组分的物质的量相等,需要氨气的物质的量=10mol×2=20mol,原平衡中参加反应氢气为30mol×80%=24mol,由方程式可知平衡时氨气的物质的量=24mol×$\frac{2}{3}$=16mol,故若开始只充入NH3,氨气的转化率=$\frac{20mol-16mol}{20mol}$×100%=20%,
故选B.
点评 本题考查化学平衡计算、等效平衡,理解等效平衡规律是解题关键,注意不同方向建立等效平衡,转化率之和为1,难度中等.


科目:高中化学 来源: 题型:解答题
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl晶体 | B. | Zn粉 | C. | SO3固体 | D. | CuSO4晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L - 1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L - 1KOH溶液,下列说法中正确的是( )| A. | 放电时K +移向负极 | |
| B. | 放电时电池负极的电极反应为H 2-2e -═2H + | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H 2O+e -═Ni(OH) 2+OH - | |
| D. | 该电池充电时将碳电极与电源的正极相连,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 浓度均为0.1 mol/L的四种溶液中由水电离出的H+浓度由大到小的顺序是:氯化铵、醋酸、硫酸、氢氧化钠 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-和CrO42-,浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先沉淀 | |
| D. | 25℃时,取0.2mol•L-1 HClO溶液与0.2mol•L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(ClO-)=9.9×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
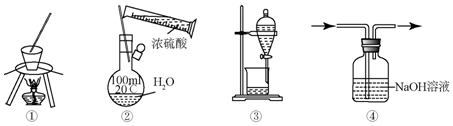
| A. | ①用于实验室从食盐水中提取氯化钠 | |
| B. | ②配制一定物质的量浓度的硫酸溶液 | |
| C. | ③用于苯萃取碘水中的碘后放出碘的苯溶液 | |
| D. | ④用于除去CO中混有的CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com