
����Ŀ��CoC2O4���Ʊ������ܵ�ԭ�ϡ����ú��ܷ��ϣ���Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��CaO��MgO��̼���л���ȣ���ȡCoC2O4�Ĺ����������£�
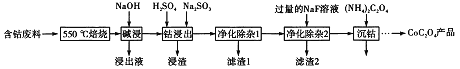
��1����500�����ա���Ŀ����_______��
��2��������Һ������Ҫ�ɷ���_______��
��3�����ܽ�����������Co3+ת��ΪCo2+����Ӧ�����ӷ���ʽΪ_________��
��4������������1�������У�����40��50�����H2O2��Һ����Ŀ����_____________���������ӷ���ʽ��ʾ������������80��85�棬����Na2CO3��Һ����pH��5��������I������Ҫ�ɷ���___________��
��5��Ϊ�ⶨ�Ƶõ�CoC2O4��Ʒ�Ĵ��ȣ��ֳ�ȡ1.00g��Ʒ���������ʵ��Լ�ת��Ϊ�����[(NH4��2C2O4����Һ�����ù���ϡ�����ữ����0.1000mol/L���������Һ�ζ����ﵽ�ζ��յ㣬����ȥ���������Һ26.00mL���ò�Ʒ�Ĵ���Ϊ_______________��
���𰸡���ȥ̼���л��� NaAlO2(NaAlO2��NaOH��Ca(OH)2Ҳ�ɵ÷�) 2Co3++SO32-+H2O=2Co2++SO42-+2H+ 2Fe2++2H++H2O2=2Fe3++2H2O Fe(OH)3����Fe(OH)3��CaSO4��CaCO3������һ�ֻ����ֶ����֣� 95.55%
��������
���ܷ�����Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��CaO��MgO��̼���л������550�����տ��Գ�ȥ̼���л�������������������Һ,�����������ܽ�����ƫ�������� Co2O3��Fe2O3��MgO�����������������Һ����Ҫ�ɷ�Ϊƫ�����ƣ���NaAlO2��NaOH��Ca(OH)2��������˵õ��Ĺ����м���ϡ����������������������ƽ�Co3+��Fe3+��ԭΪCo2+��Fe2+���ɵ�Co2+��Fe2+��Mg2+��Ca2+����40��50�����H2O2������Fe2+����ΪFe3+����������80��85��,����̼���Ƶ�pH��5,�ɵõ�������������,���˺�������Һ��Ҫ����Co2+��Mg2+��Ca2+���ⶨCoC2O4��Ʒ�Ĵ��ȣ�����5 CoC2O4-5[(NH4��2C2O4��-2KMnO4��ϵ���������CoC2O4�����������������Ʒ�Ĵ��ȣ������Ϸ������
���ܷ�����Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��CaO��MgO��̼���л������550�����տ��Գ�ȥ̼���л�������������������Һ,�����������ܽ�����ƫ�������� Co2O3��Fe2O3��MgO�����������������Һ����Ҫ�ɷ�Ϊƫ�����ƣ���NaAlO2��NaOH��Ca(OH)2��������˵õ��Ĺ����м���ϡ����������������������ƽ�Co3+��Fe3+��ԭΪCo2+��Fe2+���ɵ�Co2+��Fe2+��Mg2+��Ca2+����40��50�����H2O2������Fe2+����ΪFe3+����������80��85��,����̼���Ƶ�pH��5,�ɵõ�������������,���˺�������Һ��Ҫ����Co2+��Mg2+��Ca2+���ⶨCoC2O4��Ʒ�Ĵ��ȣ�����5 CoC2O4-5[(NH4��2C2O4��-2KMnO4��ϵ���������CoC2O4�����������������Ʒ�Ĵ��ȣ�
��1��������Ϸ�����֪����550�����ա����Գ�ȥ̼���л��������������������������ȥ̼���л��
��2��������Ϸ�����֪����������������Һ,�������ܽ�����ƫ�����������Խ���Һ����Ҫ�ɷ�Ϊƫ�����ƣ���NaAlO2��NaOH��Ca(OH)2��������������������ǣ�NaAlO2(NaAlO2��NaOH��Ca(OH)2Ҳ�ɵ÷�)��
��3�����ܽ�����������Co3+ת��ΪCo2+����SO32-��Co3+��ԭΪCo2+������������ΪSO42-����Ӧ���ӷ���ʽΪ��2Co3++SO32-+H2O=2Co2++SO42-+2H+������������������ǣ�2Co3++SO32-+H2O=2Co2++SO42-+2H+��
��4������������1�������У�����40��50�����H2O2��Һ��������������Ϊ�����ӣ�2Fe2++2H++H2O2=2Fe3++2H2O����������80��85�棬����Na2CO3��Һ����pH��5�����Եõ������������������ԡ�����I������Ҫ�ɷ���Fe(OH)3��Fe(OH)3��CaSO4��CaCO3������һ�ֻ����־��ɣ�������������������ǣ�2Fe2++2H++H2O2=2Fe3++2H2O�� Fe(OH)3����Fe(OH)3��CaSO4��CaCO3������һ�ֻ����ֶ����֣���
��5����ȡ1.00g��Ʒ���������ʵ��Լ�ת��Ϊ�����[(NH4��2C2O4����Һ�����ù���ϡ�����ữ����0.1000mol/L���������Һ�ζ����ﵽ�ζ��յ㣬����ȥ���������Һ26.00mL�����ݵ��ӵ�ʧ�غ���Եó�5 CoC2O4-5[(NH4��2C2O4��-2KMnO4��ϵ������m(CoC2O4)=5/2��26��10-3��0.1��147=0.955g����������Ʒ�Ĵ���Ϊ0.9555/1��100%=95.55%������������������ǣ�95.55%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0.2 mol/L H2A��Һ�еμ�0.2 mol/L NaOH��Һ�������ʵ����ı仯��ͼ��ʾ������˵����ȷ����
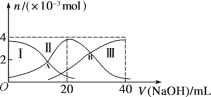
A. ��V(NaOH)=20 mLʱ����Һ������Ũ�ȹ�ϵ��c(Na��)>c(HA��)>c(A2��)>c(H��)>c(OH��)
B. ��V(NaOH)=30 mLʱ�����У�2c(H+) + c(HA-) +2c(H2A) =c(A2-) +2c(OH-)
C. ����������20 mL NaOH��Һ��������Һ���ټ���ˮ�Ĺ����У�pH��С
D. ��A��B�����Ӧ����ҺpHֵ�ֱ�Ϊa��b����H2A![]() 2H++A2-��K=10-a-b
2H++A2-��K=10-a-b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1 mol CH4������ȫȼ�շų�������Ϊ802 kJ����������ȫȼ������CO��H2Oʱ���ų�������Ϊ519 kJ�����1 mol CH4��һ����O2ȼ������CO��CO2��H2O�����ų�731.25 kJ����������һ����O2������Ϊ(����)
A. 40 g B. 56 g
C. 60 g D. 64 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У��������ͼʾ������ͨ����������һ��ת����ȫ������ǣ� ��
��� | X | Y | Z | W |
|
�� | Si | SiO2 | Na2SiO3 | H2SiO3 | |
�� | Na | NaOH | Na2CO3 | NaCl | |
�� | Cu | CuCl2 | Cu(OH)2 | CuSO4 | |
�� | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. �٢�B. �٢ۢ�C. �ڢ�D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������þ�����Ļ����Ͷ��100ml�����У�����ȫ���ܽ����������Һ�м���NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ�������ϵ��ͼ��ʾ��
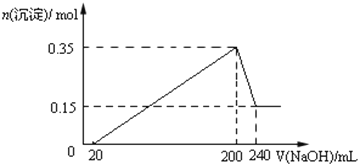
��1��ԭ�������þ������������Ϊ_______
��2��NaOH��Һ�����ʵ���Ũ��Ϊ_______ molL��1
��3�����ɵ������ڱ�״���µ����Ϊ_______ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊʵ�����¸���ת������д��������Ӧ������Լ���
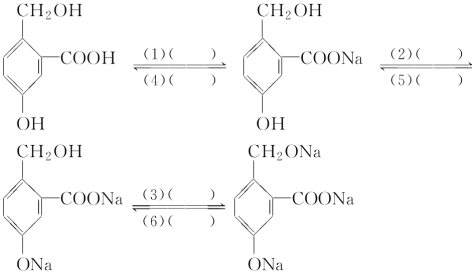
(1)________________��
(2)________________��
(3)________________��
(4)________________��
(5)________________��
(6)________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹ��ˮ��ɫ����
A.ʯ�ͷ��ֲ���������
B.ʯ���ѻ�����������
C.�����廯ʱ����������
D.�Ҵ���Ũ���ᷴӦ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����Ũ�ȵ�FeSO4��(NH4)2SO4����Ũ��Һ��Ͽ��Ƶ�һ�־��壬�þ���(��Ħ����)�Ƿ�����ѧ�г��õ�һ�ֻ�ԭ������ǿ�ȷֽⷴӦ��ѧ����ʽ��2(NH4)2Fe(SO4)2��6H2O![]() Fe2O3+2NH3��+N2��+4SO2��+17H2O������˵����ȷ����( )
Fe2O3+2NH3��+N2��+4SO2��+17H2O������˵����ȷ����( )
A. �÷�Ӧ������������N2��NH3����ԭ������SO2��Fe2O3
B. 1molĦ����ǿ�ȷֽ�ʱת�Ƶ��ӵ����ʵ���Ϊ8NA
C. ��Ħ������Һ�е�������ŨNaOH��Һ�����տɵô̼�������ͺ��ɫ����
D. �����£�Ħ���ε��ܽ�ȱ�FeSO4��(NH4)2SO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C���ֶ�����Ԫ�أ������������Ϊ+1��+2��+7�������γɵ�˫ԭ�ӹ��ۻ���������������( )
A.1��B.2��C.3��D.����3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com