
 核心素养学练评系列答案
核心素养学练评系列答案科目:高中化学 来源: 题型:
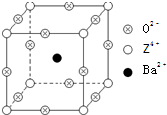 (2011?江西二模)已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
(2011?江西二模)已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】



| ||
| ||
| 233g/mol |
| (4.03×10-8 cm)3NA |
| 233g/mol |
| (4.03×10-8 cm)3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z 3种主族元素在元素周期表中的相对位置如右图所示,设X的原子序数为a,则下列说法中不正确的是( )
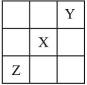
A.Y与Z的原子序数之和可能为2a B.Y的原子序数可能为a-17
C.Z的原子序数可能为a+31 D.X、Y、Z一定都是短周期元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com