
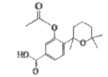
【题目】萜类化合物广泛分布于植物、昆虫及微生物体内,是多种香料和药物的主要成分。Ⅰ是一种萜类化合物,它的合成路线如图:
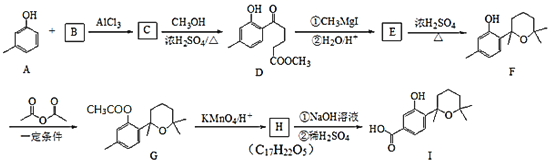
已知:R、R’、R”为烃基
ⅰ. 
ⅱ. 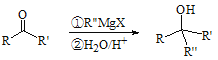 (X为I或Br,R也可以为H)
(X为I或Br,R也可以为H)
ⅲ. 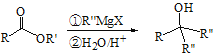 (X为I或Br)
(X为I或Br)
回答下列问题:
(1)按官能团分类,A的类别是___。
(2)A→C的反应类型是__。
(3)C中官能团名称___、___、___。一个E分子中手性碳原子的数目为____。
(4)写出下列物质的结构简式:B____、H____。
(5)F→G的反应中,乙酸酐的作用___。
(6)十九世纪末O.Wallach发现并提出了“异戊二烯法则”,即自然界中存在的萜类化合物均可以看作是异戊二烯的聚合体或衍生物,为表彰他对萜类化合物的开创性研究,1910年被授予诺贝尔化学奖。请以CH3CH2OH、CH3MgI为有机原料,结合题目所给信息,选用必要的无机试剂,补全异戊二烯(![]() )的合成路线___。
)的合成路线___。
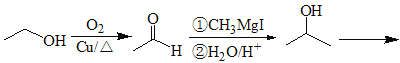
【答案】酚 取代反应 羟基 羧基 羰基 1 ![]()
 保护酚羟基不被氧化
保护酚羟基不被氧化 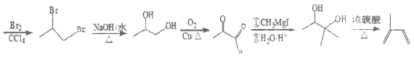
【解析】
由D的结构简式逆推可知C为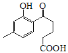 ,对比A、C的结构,结合信息I中取代反应,可推知B为
,对比A、C的结构,结合信息I中取代反应,可推知B为![]() ;对比C、F的结构,结合反应条件与信息ⅱ、ⅲ,可知E为
;对比C、F的结构,结合反应条件与信息ⅱ、ⅲ,可知E为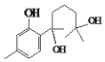 ;对比F与I的结构简式,可知从F→I转化中F中甲基为氧化为羧基转化为I,由于酚羟基易被氧化,故F与乙酸酐反应生成G,是为保护酚羟基,G中甲基氧化生成H,H发生水解反应、酸化重新引入酚羟基,故G为
;对比F与I的结构简式,可知从F→I转化中F中甲基为氧化为羧基转化为I,由于酚羟基易被氧化,故F与乙酸酐反应生成G,是为保护酚羟基,G中甲基氧化生成H,H发生水解反应、酸化重新引入酚羟基,故G为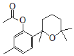 ,H为
,H为 。
。
(1)A含有酚羟基,按官能团分类,A的类别是酚类;
(2)A→C发生信息I中的取代反应生成C;
(3)分析可知C为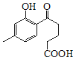 ,含有酚羟基、羰基、羧基;E为
,含有酚羟基、羰基、羧基;E为![]() ,手性碳原子为
,手性碳原子为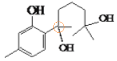 ,共1个;
,共1个;
(4)由分析可知,B的结构简式为:![]() ,H的结构简为:
,H的结构简为: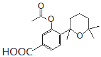 ;
;
(5)F→G的反应中,乙酸酐的作用:保护酚羟基,防止被氧化;
(6)![]() 可以由
可以由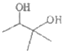 发生消去反应得到,而
发生消去反应得到,而 可以由
可以由 与CH3MgI发生题中信息(ⅱ)的反应,
与CH3MgI发生题中信息(ⅱ)的反应, 可以由
可以由![]() 发生催化氧化反应得到,结合给予的信息可知,
发生催化氧化反应得到,结合给予的信息可知,![]() 可由
可由![]() 与Br2发生加成反应,再水解得到,则补全异戊二烯(
与Br2发生加成反应,再水解得到,则补全异戊二烯(![]() )的合成路线:
)的合成路线: 。
。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关溶液中离子存在和转化的表达合理的是( )
A.中性溶液中可能大量存在Fe3+、K+、Cl-、SO![]()
B.离子方程式2Ca2++3HCO![]() +3OH-═2CaCO3↓+CO
+3OH-═2CaCO3↓+CO![]() +3H2O可以表示NH4HCO3与澄清石灰水反应
+3H2O可以表示NH4HCO3与澄清石灰水反应
C.由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO![]()
D.n[NH4Al(SO4)2]:n[Ba(OH)2]=2:5时发生的反应为NH![]() +Al3++2SO
+Al3++2SO![]() +2Ba2++5OH-═NH3H2O+AlO
+2Ba2++5OH-═NH3H2O+AlO![]() +2H2O+2BaSO4↓
+2H2O+2BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质量相同的H2O和D2O所含质子数之比为______,中子数之比为___,分别与足量的金属钠反应生成气体在同温同压下体积之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将以下4份溶液分别置于如图的装置中,其他条件相同时,灯泡最亮的是( )
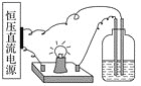
A. 100 mL 1 mol·L-1的盐酸
B. 100 mL 2 mol·L-1的蔗糖溶液
C. 100 mL 1 mol·L-1的氯化钠溶液
D. 30 mL 1 mol·L-1的氯化钙溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d、e的原子序数依次增大。a的简单阴离子与锂离子具有相同的电子层结构,b原子最外层电子数等于内层电子数的2倍。d的单质与稀盐酸剧烈反应放出a2。在1L0.2mol·L-1a2e的水溶液中缓慢通入ec2气体,该溶液的pH与ec2气体体积(标准状况)的关系如图所示。下列说法不正确的是
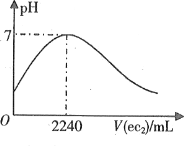
A.a和b可构成所有原子共平面的分子
B.在b、c、e的气态氢化物中,c的最稳定
C.d的氯化物一定能破坏水的电离平衡
D.e的最高价含氧酸与其氢化物可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.可逆反应3A(g)![]() 3B(?)+C(?) △H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?) △H>0,达到化学平衡后,进行下列操作。
(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量___;
②若B、C都不是气体,气体的平均相对分子质量___;
③若B是气体,C不是气体,气体的平均相对分子质量___;
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是___态,C的状态是__态。
(3)某密闭容器中放入一定量的NO2,发生反应2NO2![]() N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是___。
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是___。
A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K 和温度T的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K 和温度T的关系如下表所示:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___;
(2)该反应为___反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是___
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:[CO2]·[H2]=[CO]·[H2O],试判断此时的温度为__℃;
(5)830℃充入等体积的CO2 和H2 达到平衡后CO2 的转化率为___;
Ⅲ.运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下__(填“能”或“不能”)自发进行。
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下__(填“能”或“不能”)自发进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)己达到平衡状态的是( )
C(g)+D(g)己达到平衡状态的是( )
①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1 : 1
A. ①③④⑤ B. ①③④⑤⑧⑨ C. ①②③④⑤⑦ D. ①②③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。

据图回答下列问题:
(1)写出A、C、D的结构简式:
A________,C________,D________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________________(反应类型____________)。
②________________________________(反应类型____________)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com