
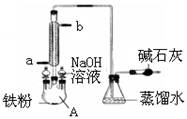
| A.左侧的分液漏斗中加入的是苯和溴水 |
| B.仪器A的名称叫蒸馏烧瓶 |
| C.锥形瓶中的导管口出现大量白雾 |
| D.碱石灰作用是防止空气中水蒸气进入反应体系 |
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NaHSO4+HNO3↑,制取HNO3时,下图所列装置中最适合的是
NaHSO4+HNO3↑,制取HNO3时,下图所列装置中最适合的是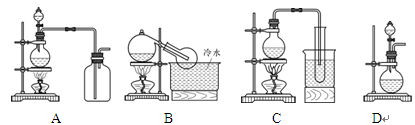
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
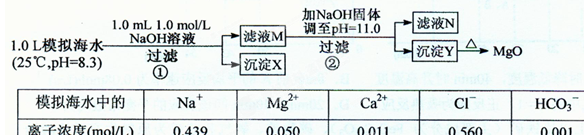
| A.沉淀物X为CaCO3 |
| B.滤液M中存在Mg2+,不存在Ca2+ |
| C.滤液N中存在Mg2+、Ca2+ |
| D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
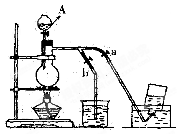
 。(填:如何操作a、b止水夹,下同),
。(填:如何操作a、b止水夹,下同),查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
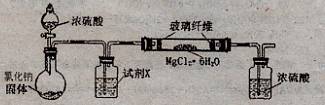
 后,过滤;
后,过滤;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com