
����Ŀ���衢��(32Ge���۵� 937��)����(31Ga)������Ҫ�İ뵼����ϣ��ں��պ����ء�������̽�⡢����ͨѶ�������ѧ��̫���ܵ�ء���ѧ����������ҽѧ�������й㷺����Ҫ��Ӧ�á��������ͬ����Ԫ�ء�
(1)����Ԫ�����ڱ��е�λ����________��
(2)���������Ԫ�ض����γ��Ȼ��� RCl4(R����Si��Ge)����ԭ�ӽṹ�ǶȽ���ԭ�� _______��
(3)��Ȼ���ʯ����Ũ�ȷdz��ͣ���˴���ӹ�����(������̬��)�л�������һ�ַdz���Ҫ�ķ�������ͼ��һ����ȡ������̣�
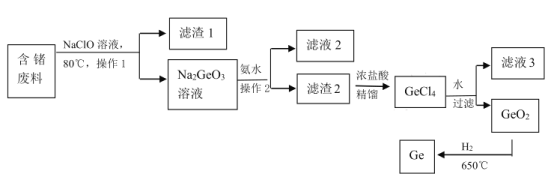
��NaClO ��Һ��ȡ��������е���ʱ������Ӧ�����ӷ���ʽΪ_____��Ϊ�˼�NaClO ��Һ��ȡ������ϵ����ʣ����Բ�ȡ�Ĵ�ʩ��_____��
�ڲ��� 1 �Ͳ��� 2 ��____��
�� GeO2 ���۵�Ϊ 1086�棬����������ԭGeO2��ÿ���� 146kg ����ų� akJ ���������÷�Ӧ���Ȼ�ѧ����ʽΪ_______��
���𰸡��������� IV A �� ������Ϊ 4 �����ӣ��������γ� 4 �����õ��ӶԴﵽ�ȶ��ṹ Ge + 2ClO- + 2OH-![]() GeO32-+ 2Cl- + H2O �����¶Ȼ��������������Һ��Ũ�Ȼ���麬����ϻ���� ���� GeO2(s) + 2H2(g)
GeO32-+ 2Cl- + H2O �����¶Ȼ��������������Һ��Ũ�Ȼ���麬����ϻ���� ���� GeO2(s) + 2H2(g) ![]() Ge(s) + 2H2O(g) ��H= -(a/2000)kJ/mol
Ge(s) + 2H2O(g) ��H= -(a/2000)kJ/mol
��������
���ݹ��ԭ�ӽṹʾ��ͼ�ж��������ڱ���λ�ã�����Si��Geͬ����Ԫ�أ��ṹ���ƽ��ͣ���������ͼʾ��Ϣд�����ӷ���ʽ�Ͳ���1��2�IJ���������Ӱ�췴Ӧ���ʵ����أ�Ϊ�˼ӿ췴Ӧ����Ӧ��ȡ�Ĵ�ʩ������������Ϣ���㷴Ӧ�Ȳ�д���Ȼ�ѧ����ʽ��
��1�����ԭ������Ϊ14��ԭ�Ӻ�����14�����ӣ���ԭ�ӽṹʾ��ͼΪ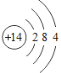 �����������Ӳ㣬�����4�����ӣ���Siλ��Ԫ�����ڱ��������ڵڢ�A�壻��Ϊ�������ڵڢ�A�塣
�����������Ӳ㣬�����4�����ӣ���Siλ��Ԫ�����ڱ��������ڵڢ�A�壻��Ϊ�������ڵڢ�A�塣
��2���衢��Ǣ�A��Ԫ�أ�ԭ������㶼��4�����ӣ�������4����ԭ���Թ��ۼ���ʽ�γ�4�Թ��õ��Ӷԣ��ﵽ8���ӵ��ȶ��ṹ����Ϊԭ������㶼��4�����ӣ�������4����ԭ���Թ��ۼ���ʽ�γ�4�Թ��õ��Ӷԣ��ﵽ8���ӵ��ȶ��ṹ��
��3����������ͼ��֪������������Һ�����������ԭ��Ӧ���������ơ��Ȼ��ƺ�ˮ����Ӧ�����ӷ���ʽΪ2ClO-+Ge+2OH-![]() 2Cl-+GeO32-+H2O��Ϊ�˼ӿ����������Һ��ȡ������ϵ����ʣ����������¶ȣ�����Ũ�ȣ���������������ȿ��Լӿ췴Ӧ���ʣ������ȡ�����¶Ȼ��������������Һ��Ũ�Ȼ���麬����ϻ����ȴ�ʩ�ӿ��ȡ���ʣ���Ϊ�����¶Ȼ��������������Һ��Ũ�Ȼ���麬����ϻ���衣
2Cl-+GeO32-+H2O��Ϊ�˼ӿ����������Һ��ȡ������ϵ����ʣ����������¶ȣ�����Ũ�ȣ���������������ȿ��Լӿ췴Ӧ���ʣ������ȡ�����¶Ȼ��������������Һ��Ũ�Ȼ���麬����ϻ����ȴ�ʩ�ӿ��ȡ���ʣ���Ϊ�����¶Ȼ��������������Һ��Ũ�Ȼ���麬����ϻ���衣
��������ͼ��֪������1�Ͳ���2���ǹ�Һ���룬��������Ϊ���ˣ���Ϊ���ˡ�
���������֪���������������������Ӧ���������̬ˮ��146000g������ʵ���Ϊ![]() =2000mol��������1mol��ų�������Ϊ
=2000mol��������1mol��ų�������Ϊ![]() kJ����Ӧ���Ȼ�ѧ����ʽΪGeO2(s) + 2H2(g)
kJ����Ӧ���Ȼ�ѧ����ʽΪGeO2(s) + 2H2(g) ![]() Ge(s) + 2H2O(g) ��H= -
Ge(s) + 2H2O(g) ��H= -![]() kJ/mol����ΪGeO2(s) + 2H2(g)
kJ/mol����ΪGeO2(s) + 2H2(g) ![]() Ge(s)+2H2O(g) ��H= -
Ge(s)+2H2O(g) ��H= -![]() kJ/mol��
kJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪MnO![]() ��NO
��NO![]() �������������¾���ǿ�����ԣ���S2����I����Fe2���Ⱦ��н�ǿ�Ļ�ԭ�ԡ�����ˮ��Һ�еĸ���������Ϊ����������ԭ��Ӧ�����ܴ����������( )
�������������¾���ǿ�����ԣ���S2����I����Fe2���Ⱦ��н�ǿ�Ļ�ԭ�ԡ�����ˮ��Һ�еĸ���������Ϊ����������ԭ��Ӧ�����ܴ����������( )
A. Na����Ba2����Cl����SO42�� B. MnO4-��K����I����H��
C. Ca2����HCO3����Cl����K�� D. H����Cl����Na����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦaA (g) + bB (s) ![]() cC (g) + dD (g)�ڷ�Ӧ�����У������������䣬C�����ʵ���������T��P��ϵ��ͼ��ʾ��������������ȷ���ǣ� ��
cC (g) + dD (g)�ڷ�Ӧ�����У������������䣬C�����ʵ���������T��P��ϵ��ͼ��ʾ��������������ȷ���ǣ� ��
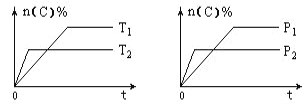
A. �¶Ƚ��ͣ���ѧƽ�����淴Ӧ�����ƶ�
B. ʹ�ô�����C�����ʵ�����������
C. ��ѧ����ʽϵ��a ��c��d
D. ������ͼ��ȷ���ı��¶Ⱥ�ѧƽ���ƶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���25 mL0.12 mol/L AgNO3��Һ����μ���Ũ��Ϊ2%�İ�ˮ���ȳ��ֳ����������μӳ����ܽ⡣�ù����м��백ˮ�����V����Һ��lg �Ĺ�ϵ��ͼ��ʾ����֪e��ʱ��ҺѸ���ɻ��DZ�ó��壬�Ҵ�ʱ��Һ��c(Ag+)��c(NH3)��ԼΪ2��10-3 mol/L��������������ȷ���ǣ� ��
�Ĺ�ϵ��ͼ��ʾ����֪e��ʱ��ҺѸ���ɻ��DZ�ó��壬�Ҵ�ʱ��Һ��c(Ag+)��c(NH3)��ԼΪ2��10-3 mol/L��������������ȷ���ǣ� ��

A.a����Һ�����Ե�ԭ����AgNO3ˮ��
B.b����Һ�У�c(Ag+)+c[Ag(NH3)2+]��c(NO3-)
C.��e���֪����ӦAg++2NH3![]() [Ag(NH3)2]+ƽ�ⳣ����������Ϊ105
[Ag(NH3)2]+ƽ�ⳣ����������Ϊ105
D.c��d�μ���İ�ˮ��Ҫ���ڳ��������ɺ��ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NiԪ�������������������Ź㷺��Ӧ�á��ش���������:
(1)��̬Niԭ�Ӽ۲���ӵ��Ų�ʽΪ_______��
(2)��ѧ�����о�������������ֵĹ����У�������Cu-Ni-Fe�ȶ��ֽ��������ȷ��ij�ֽ����������Ǿ��廹�ǷǾ�����ɿ��Ŀ�ѧ�����ǶԹ������______��
(3)Ni������±��(SCN)2��Ӧ����Ni(SCN)2��Ni(SCN)2�У���һ����������Ԫ����____��(SCN)2�����У���ԭ�ӵ��ӻ���ʽ��___��������������Ŀ֮��Ϊ_____��
(4)[Ni(NH3)6](NO3)2�У������ڵĻ�ѧ��Ϊ_____(����)��
a�����Ӽ� b�������� c����λ�� d�����
(5)����CO��N2���۷е�ߵ�ԭ��___��
(6)���Ͻ�����о���ȡ�úܴ��չ��
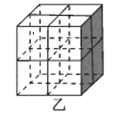
��ͼ����һ�������Ͻ����ľ����ṹʾ��ͼ���úϽ����1 mol La�ĺϽ������H2����ĿΪ___��
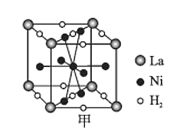
��Mg2NiH4��һ������Ľ����⻯���Mg2NiH4�����У�Niԭ��ռ����ͼ�ҵĶ�������ģ�Mg2+������ͼ�˸�С����������ġ�Mg2+λ��Niԭ���γɵ�___�������������϶�������������϶��������������ܶ�Ϊd g/cm3��Mg2NiH4��Ħ������ΪM g/mol����Mg2+��Niԭ�ӵ���̾���Ϊ___nm(�ú�d��M��NA�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȴ�������������������ɿ������ɱ�����������������Ӧ�����γɵģ���ͼ��������˵����ȷ����

A. ������(A)�������Ҵ�������Ӧ
B. ������(B)����ʽΪC6H6Cl6
C. ������(B)��ͨ������Cl2�����ӳɷ�Ӧ�Ƶ�
D. 1mol������(A)����3molH2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ԫ����B(OH)2��ˮ�д������µ���ƽ�⣺B(OH)2 ![]() B(OH)++OH-��Kb1=10-3.75��B(OH)+
B(OH)++OH-��Kb1=10-3.75��B(OH)+![]() B2++OH-��Kb2=10-7.62�������£���0.1 mol/L����ζ�25 mL 0.1 mol/L��B(OH)2��Һ���õ���ͼ��ʾ�ĵζ����ߡ�����˵������ȷ����
B2++OH-��Kb2=10-7.62�������£���0.1 mol/L����ζ�25 mL 0.1 mol/L��B(OH)2��Һ���õ���ͼ��ʾ�ĵζ����ߡ�����˵������ȷ����

A. a�����õ���Һ�У�c[B(OH)2]= c[B(OH)+]
B. b�����õ���Һ�У�c[B(OH)2] +c(OH-)=c(B2+)+c(H+)
C. c�����õ���Һ�У�c(Cl-)��3c[B(OH)+]
D. d�����õ���Һ�У�c(B2+)��c[B(OH)+]��c[B(OH)2]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 mol��L��1 CH3COOH��Һ�д������µ���ƽ�⣺ CH3COOH ![]() CH3COO����H+�����ڸ�ƽ�⣬����������ȷ���ǣ� ��
CH3COO����H+�����ڸ�ƽ�⣬����������ȷ���ǣ� ��
A. ����ˮʱ��ƽ�����淴Ӧ�����ƶ�
B. ��������NaOH���壬ƽ��������Ӧ�����ƶ�
C. ��������0.1 mol��L��1 HCl��Һ����Һ��c(H+)��С
D. ��������CH3COONa���壬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ��Ʊ�װ�á��Ʊ�ʱʹ�õ�ԭ�����ռ���������ȷ���ǣ� ��
��� | ���� | �Ʊ�װ�� | �Ʊ�ʱʹ�õ�ԭ�� | �ռ����� | ��� | ���� | �Ʊ�װ�� | �Ʊ�ʱʹ�õ�ԭ�� | �ռ����� |
A |
|
|
| ��ˮ�� | B | NO |
| Ũ����ͽ���ͭ | �ſ����� |
C |
|
| Ũ��ˮ���������ƹ��� | �ſ����� | D |
|
| �Ҵ��� | ��ˮ�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com