
晶体具有规则的几何外形,晶体中最基本的重复单位被称为晶胞。中学教材中NaCl晶体结构即为NaCl的一个晶胞。已知FexO晶体的晶胞结构为NaCl型,由于晶体缺陷,x<1。实验测得FexO晶体的密度为5.71g/cm3,晶胞的边长为4.28×10-5m。NaCl的晶胞如图所示:
(1)求FexO中X的具体数值(精确至0.01)为 ,晶体中Fe元素只有+2和+3价,则在Fe2+、Fe3+ 的总数中,Fe2+所占分数(用小数表示,精确至0.001)为
(2)此晶体的化学式为
(3)晶体中与O2-距离最近且相等的Fe2+或Fe3+所围成的几何构形是 (4)晶体中,Fe离子间最近距离为 cm
(4)晶体中,Fe离子间最近距离为 cm
1)0.92 , 0.826 (各1分)
2 Fe2+0.76 Fe3+0.16O ( 2分)
3)正八面体 ( 2分)
4)3.03×10-8 ( 2分)
解析NaCl型,每个晶胞中含有4个“NaCl”。模仿NaCl,先求摩尔体积,再求摩尔质量。
Vm=(4.28×10―8) 3×NA/4 cm3·mol-1
M=5.719×Vm g·mol-1=67.48g·mol-1
⑴x=(67.48-16)/55.9=0.92
⑵根据电荷守恒,或化合价代数和为0,求出Fe2+(a)与Fe3+(b)。
2a+3b=2
a+b=0.92
得a=0.76
b=0.16
0.76/0.92=0.826即82.6%
⑶正八面体(参见NaCl晶体图)
⑷设Fe在面心,另外的正方形的四个顶点(参见NaCl晶体)
则:求对角线的一半即为最短距离。 ×(4.28×10―10)/2 m=3.03×10―10m==3.03×10―8cm
×(4.28×10―10)/2 m=3.03×10―10m==3.03×10―8cm


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:吉林省长春外国语学校2011-2012学年高二下学期期末考试化学试题 题型:022
(1)熔点沸点HF________HI;原因:________.
(2)各种含氧酸HClO、HClO3、H2SO3、HClO4的酸性由强到弱排列为________.
(3)下列4种物质熔点沸点由高到低排列为________(填序号).
①金刚石(C-C)②锗(Ge-Ge)
③晶体硅(Si-Si)④金刚砂(Si-C)
(4)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如下图所示.晶体中每个Na+同时吸引着________个Cl-,由这些Cl-构成的几何构型为________晶体中在每个Cl-周围与它最接近且距离相等的Cl-共有________个.

(5)某元素的激发态原子的电子排布式为1s22s22p63s23p34s1,则该元素基态原子的电子排布式为________;其最高价氧化物对应的水化物的化学式是________.
(6)某元素原子的价电子构型为3d104S2,它属于第________周期,是________族,________区元素,元素符号是________.该原子核外有________个能级,电子云的形状有________种.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年吉林省长春外国语学校高二下学期期末考试化学试卷(带解析) 题型:填空题
(1)、熔点沸点HF HI;原因:
(2)、各种含氧酸HClO、HClO3、H2SO3、HClO4的酸性由强到弱排列为
(3)、下列4种物质熔点沸点由高到低排列为________ (填序号)
①金刚石(C—C)②锗(Ge—Ge)
③晶体硅(Si—Si)④金刚砂(Si—C)
(4)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。
晶体中每个Na+同时吸引着______个Cl-,由这些 Cl-构成的几何构型为 晶体中在每个Cl-周围与它最接近且距离相等的Cl-共有________个。
(5)某元素的激发态原子的电子排布式为1s 2s
2s 2p
2p 3s
3s 3p
3p 4s
4s ,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是
(6)某元素原子的价电子构型为3d104S2,它属于第 周期,是 族, 区元素,元素符号是 。该原子核外有 个能级,电子云的形状有 种
查看答案和解析>>
科目:高中化学 来源:2013届吉林省高二下学期期末考试化学试卷(解析版) 题型:填空题
(1)、熔点沸点HF HI;原因:
(2)、各种含氧酸HClO、HClO3、H2SO3、HClO4的酸性由强到弱排列为
(3)、下列4种物质熔点沸点由高到低排列为________ (填序号)
①金刚石(C—C)②锗(Ge—Ge)
③晶体硅(Si—Si)④金刚砂(Si—C)
(4)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。

晶体中每个Na+同时吸引着______个Cl-,由这些 Cl-构成的几何构型为 晶体中在每个Cl-周围与它最接近且距离相 等的Cl-共有________个。
(5)某元素的激发态原子的电子排布式为1s 2s
2s 2p
2p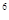 3s
3s 3p
3p 4s
4s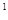 ,则该元素基态原子的电子排布式为
;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为
;其最高价氧化物对应的水化物的化学式是
(6)某元素原子的价电子构型为3d104S2,它属于第 周期,是 族, 区元素,元素符号是 。该原子核外有 个能级,电子云的形状有 种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com