
【题目】二氧化铈(![]() )是一种重要的稀土化合物。以氟碳铈矿(主要含
)是一种重要的稀土化合物。以氟碳铈矿(主要含![]() )为原料制备
)为原料制备![]() 的一种工艺流程如图:
的一种工艺流程如图:
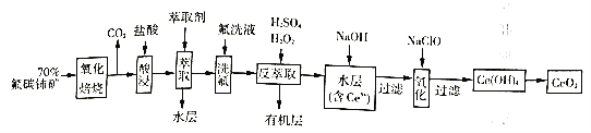
已知:①![]() 能与
能与![]() 结合成
结合成![]() ,也能与
,也能与![]() 结合成
结合成![]() ;②
;②![]() 在硫酸体系中能被萃取剂
在硫酸体系中能被萃取剂![]() 萃取,而
萃取,而![]() 不能。回答:
不能。回答:
(1)“氧化培烧”前需将矿石粉碎成细颗粒,其目的是_________。
(2)“酸浸”中会产生大量黄绿色气体,写出![]() 与盐酸反应的离子方程式:____________;为避免产生上述污染,解决方案为__________。
与盐酸反应的离子方程式:____________;为避免产生上述污染,解决方案为__________。
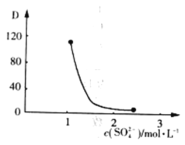
(3)“萃取”时存在反应:![]() 。实验室中萃取时要用到的主要玻璃仪器名称为__________;图中D是分配比,表示
。实验室中萃取时要用到的主要玻璃仪器名称为__________;图中D是分配比,表示![]() (Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比
(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比![]() 。保持其它条件不变,在起始料液中加入不同量的
。保持其它条件不变,在起始料液中加入不同量的![]() 以改变水层中的
以改变水层中的![]() ,D随起始料液中
,D随起始料液中![]() 变化的原因:_____________。在
变化的原因:_____________。在![]() 的条件下,取
的条件下,取![]() 含四价铈总浓度为
含四价铈总浓度为![]() 的酸浸液,向其中加入
的酸浸液,向其中加入![]() 萃取剂
萃取剂![]() ,充分振荡,静置,水层中
,充分振荡,静置,水层中![]() _________。(结果保留二位有效数字)。
_________。(结果保留二位有效数字)。
(4)“反萃取”中,在稀硫酸和![]() 的作用下
的作用下![]() 转化为
转化为![]() 。
。![]() 在该反应中作用与下列反应中
在该反应中作用与下列反应中![]() 的作用相同的是________。
的作用相同的是________。
A.![]() 处理含酸性重铬酸钾的废水
处理含酸性重铬酸钾的废水
B.![]() 和二氧化锰混合制氧气
和二氧化锰混合制氧气
C.![]() 与氧化钙制过氧化钙
与氧化钙制过氧化钙
D.![]() 在海带提碘实验中的作用
在海带提碘实验中的作用
(5)“氧化”步骤的化学方程式为:___________。
(6)取上述流程中得到的![]() 产品
产品![]() ,加硫酸溶解后,用
,加硫酸溶解后,用![]() 溶液滴定至终点时(铈被还原为
溶液滴定至终点时(铈被还原为![]() ,其他杂质均不反应,
,其他杂质均不反应,![]() 为无色),用
为无色),用![]() 标准酸性
标准酸性![]() 溶液滴定过量的
溶液滴定过量的![]() ,消耗
,消耗![]() 标准溶液。该产品中
标准溶液。该产品中![]() 的质量分数为________。
的质量分数为________。
【答案】增大固体与气体的接触面积,增大反应速率,提高原料的利用率 ![]() 将
将![]() (盐酸)改用
(盐酸)改用![]() 酸浸 分液漏斗 随着
酸浸 分液漏斗 随着![]() 增大,水层中
增大,水层中![]() 被
被![]() 结合成
结合成![]() ,导致萃取平衡向逆向移动,D迅速减小
,导致萃取平衡向逆向移动,D迅速减小 ![]() A
A ![]()
![]()
【解析】
氟碳铈矿(主要含CeFCO3),“氧化焙烧”的目的是将+3价铈氧化成+4价,Ce4+能与F-结合成[CeFx](4-x)+,以便后续的提取,加稀硫酸,与SO42-结合成[CeSO4]2+,加萃取剂,氟洗液,硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能,“反萃取”加H2O2,又将Ce4+还原为Ce3+,发生反应2Ce4++H2O2=2Ce3++O2↑+2H+,加入碱后Ce3+转化为沉淀,通入氧气讲将e从+3氧化为+4,得到产品,据此回答问题。
(1)“氧化焙烧”前需将矿石粉碎成细颗粒是为了增加固体与氧气接触面积燃烧充分,增大固体和氧气的接触面积,反应更充分;
(2) “酸浸”中会产生大量黄绿色气体应为氯气,CeO2与盐酸发生氧化还原反应生成Ce3+和氯气,可以用硫酸代替盐酸而避免产生氯气污染;
(3) 实验室中萃取时用到的主要玻璃仪器名称为分液漏斗,根据平衡![]() ,加入Na2SO4时,随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向左移动,D迅速减小。在
,加入Na2SO4时,随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向左移动,D迅速减小。在![]() 的条件下,
的条件下,![]() ,即
,即![]() ,依据题意,
,依据题意,![]() ×
×![]() =20mL×
=20mL×![]() +
+![]() ×80×
×80×![]() ,
,![]()
![]() 。
。
(4) “反萃取”加H2O2的作用是将Ce4+离子重新还原为Ce3+,H2O2在该反应中作还原剂。
A.![]() 处理含酸性重铬酸钾的废水,过氧化氢做还原剂,A正确;
处理含酸性重铬酸钾的废水,过氧化氢做还原剂,A正确;
B.![]() 和二氧化锰混合制氧气,发生歧化反应,既是氧化剂,又是还原剂,B错误;
和二氧化锰混合制氧气,发生歧化反应,既是氧化剂,又是还原剂,B错误;
C.![]() 与氧化钙制过氧化钙,不发生氧化还原反应,C错误;
与氧化钙制过氧化钙,不发生氧化还原反应,C错误;
D.![]() 在海带提碘实验中作氧化剂,D错误。
在海带提碘实验中作氧化剂,D错误。
答案为A。
(5) “氧化”步骤中用次氯酸钠将Ce3+氧化成Ce4+,反应的化学方程式为![]() 。
。
(6) ![]() 溶液中Fe2+的物质的量为av1×10-3mol,用
溶液中Fe2+的物质的量为av1×10-3mol,用![]() 标准酸性
标准酸性![]() 溶液滴定过量的
溶液滴定过量的![]() ,反应为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,消耗
,反应为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,消耗![]() 标准溶液,即亚铁离子与Ce4+反应了av1×10-3mol-5bv2×10-3mol,根据电子得失守恒可得关系式Ce4+~Fe2+,所以CeO2的质量为(av1×10-3-5bv2×10-3)mol×172g/mol=172 (av1×10-3-5bv2×10-3) g,产品中CeO2的质量分数为
标准溶液,即亚铁离子与Ce4+反应了av1×10-3mol-5bv2×10-3mol,根据电子得失守恒可得关系式Ce4+~Fe2+,所以CeO2的质量为(av1×10-3-5bv2×10-3)mol×172g/mol=172 (av1×10-3-5bv2×10-3) g,产品中CeO2的质量分数为![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。
如图是制取溴苯的装置。试回答:

(1)装置A中发生反应的化学方程式是_________________________。
(2)装置C中看到的现象是____________________,证明________________________。
(3)装置B是吸收瓶,内盛CCl4液体,实验中观察到的现象是________,原因是____________。
如果没有B装置而将A、C直接相连,你认为是否妥当?________(填“是”或“否”),理由是______________________。
(4)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯______________(填“上”或“下”)层为溴苯,这说明溴苯______________且______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
实验装置 | 实验现象 |
| a处试纸变蓝; b处变红,局部褪色; c处无明显变化; d处试纸变蓝 |
下列对实验现象的解释或推测不合理的是
A. a为电解池的阴极
B. b处有氯气生成,且与水反应生成了盐酸和次氯酸
C. c处发生了反应:Fe-3e- = Fe3+
D. d处:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL均为0.1mol·L-1的MOH和NH3·H2O混合液中滴加0.1mol·L-1的CH3COOH溶液,测得混合液的电阻率(表示电阻特性的物理量)与加入CH3COOH溶液的体积(V)的关系如图所示。已知:CH3COOH的Ka=l.8×10-5,NH3H2O的Kb=l.8×l0-5。下列说法错误的是( )
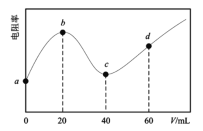
A.碱性:MOH>NH3·H2O
B.c点溶液中浓度:c(CH3COOH)>c(NH3H2O)
C.d点溶液的pH≈5
D.a→d过程中水的电离程度先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①关闭止水夹K2,打开止水夹K1,开始制取氨气。
②加热装置A中的金属钠,使其熔化并充分反应后,停止通入氨气并关闭止水夹K1。
③向装置A中的b容器内充入加热介质,并加热到210~220℃,然后打开止水夹K2,制取并通入N2O。
请回答下列问题:
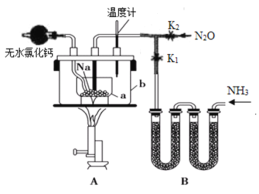
(1)制取氨气可选择的装置是__(填序号,下同),N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是__。
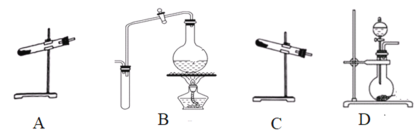
(2)步骤①中先通氨气的目的是__,步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__,步骤③中最适宜的加热方式为___。
(3)生成NaN3的化学方程式为___。
(4)反应完全结束后,进行以下操作,得到NaN3固体:
a中混合物![]() NaN3固体
NaN3固体
已知NaNH2能与水反应生成NaOH和氨气。操作Ⅱ的目的是___,操作Ⅳ最好选用的试剂是___。
(5)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500g试样配成500.00mL溶液。②取50.00mL溶液置于锥形瓶中,加入50.00mL0.1010mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示剂,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑、Ce4++Fe2+=Ce3++Fe3+,试样中NaN3的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境密切相关,下列有关说法正确的是( )
A.污水中![]() ,
,![]() ,
,![]() 等有毒,可用
等有毒,可用![]() 处理
处理
B.采取“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法,可提高空气质量
C.谷氨酸一钠用于调味,小苏打不可用于油污清洗
D.我国全面启动的北斗导航系统的信号传输与硅有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下面的横线上填上适当的内容。
(1)![]() 个Na+约含__________mol Na+,其质量为______________g。
个Na+约含__________mol Na+,其质量为______________g。
(2)4.5molCH4约含有___________个CH4,其质量为____________g。
(3)![]() 个SO42-约含________mol SO42-,其质量为___________g;49g H2SO4 约含有______个H,共含有___________个原子。
个SO42-约含________mol SO42-,其质量为___________g;49g H2SO4 约含有______个H,共含有___________个原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,流程如下:

(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为 。能提高烧渣浸取速率的措施有 (填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是 (填字母)。

A.Fe粉 B.SO2 C.NaI
还原结束时,溶液中的主要阴离子有 。
(3)滤渣Ⅱ主要成分的化学式为 ;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是 、 过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
(资料查阅)
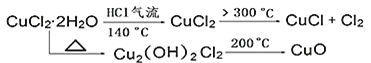
(实验探究)该小组用如图所示装置进行实验(夹持仪器略)。
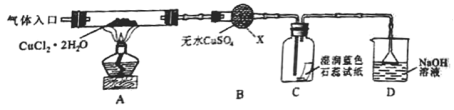
请回答下列问题:
(1)仪器X的名称是__________。
(2)实验操作的先后顺序是a→______ →e(填操作的编号)
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com