

| A. | 原子半径:A<B<C<D | |
| B. | E、F和H三种元素相应的最高价氧化物对应水化物之间两两会发生反应 | |
| C. | 气态氢化物稳定性:D>I>G>H | |
| D. | E和C元素形成的化合物中只存在离子键 |
分析 都是短周期元素,由最外层电子数与原子序数关系可知,A、B、C、D处于第二周期,A、B、C、D的最外层电子数依次为4、5、6、7,故A为碳元素、B为N元素、C为O元素、D为F元素;E、F、G、H、I处于第三周期,最外层电子数分别为1、3、5、6、7,故E为Na元素、F为Al元素、G为P元素、H为S元素、I为Cl元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:都是短周期元素,由最外层电子数与原子序数关系可知,A、B、C、D处于第二周期,A、B、C、D的最外层电子数依次为4、5、6、7,故A为碳元素、B为N元素、C为O元素、D为F元素;E、F、G、H、I处于第三周期,最外层电子数分别为1、3、5、6、7,故E为Na元素、F为Al元素、G为P元素、H为S元素、I为Cl元素.
A.同周期自左而右原子半径减小,故原子半径A>B>C>D,故A错误;
B.E、F和H三种元素相应的最高价氧化物对应水化物分别为氢氧化钠、氢氧化铝、硫酸,氢氧化钠与硫酸发生中和反应,氢氧化铝属于两性氢氧化物,与氢氧化钠、硫酸反应,故B正确;
C.同周期自左而右,非金属性增强,非金属性越强,气态氢化物越稳定,故气态氢化物的稳定性H2O>PH3,故C错误;
D.N元素、O元素形成的化合物只存在共价键,故D错误,
故选B.
点评 本题考查结构性质位置关系、元素周期律等,难度不大,根据最外层电子数及原子序数的关系确定元素是解题的关键,注意整体把握元素周期表的结构.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸除水垢:2CH3COO-+2H++CaCO3═(CH3COO)2Ca+CO2↑+H2O | |
| B. | 澄清石灰水中滴加少量NaHCO3:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 稀硫酸除铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| D. | 酸性条件下KIO3与KI溶液反应:IO3-+5I-+3H2O═3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
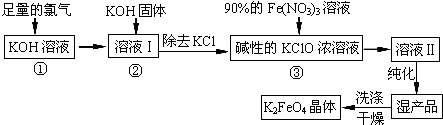
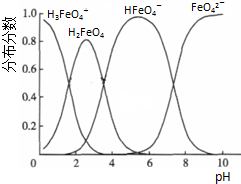
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
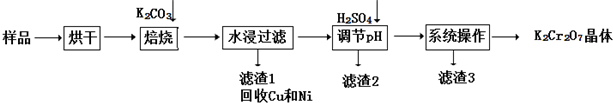
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 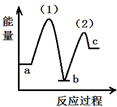 | B. | 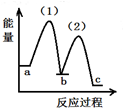 | C. | 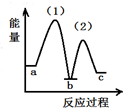 | D. | 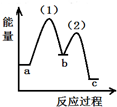 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
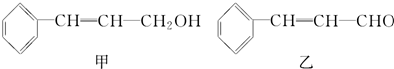
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
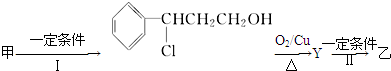
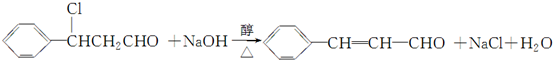 (注明反应条件).
(注明反应条件).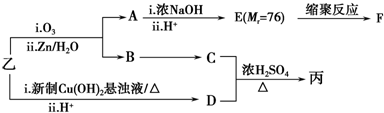
 .
.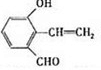 .
.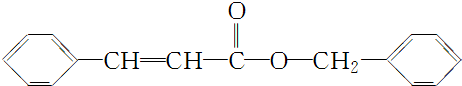 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1 | |
| B. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| C. | 在50℃时,pH=2的硫酸与pH=12的NaOH溶液等体积混合后,溶液的pH=7 | |
| D. | pH均等于5的HCl溶液和NH4Cl溶液中,水的电离程度相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com