
下列各组化合物中,不论以什么比例混合,只要总物质的量一定,则完全燃烧生成H2O的量和消耗O2的量不变的是( )
A. CH4O C3H4O5 B. C3H6 C4H6O3
C. C2H2 C6H6 D. C3H8 C4H6
科目:高中化学 来源:2017届天津市高三第四次月考化学试卷(解析版) 题型:选择题
巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是
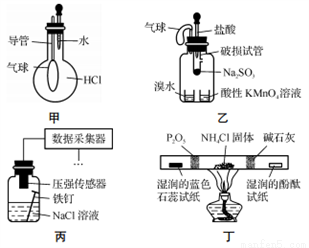
A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市高二下学期学业水平测试(二)化学试卷(解析版) 题型:选择题
过氧乙酸(CH3COOOH)的制备反应为:CH3COOH +H2O2 CH3COOOH+H2O,下列有关该反应的说法正确的是
CH3COOOH+H2O,下列有关该反应的说法正确的是
A. 当消耗CH3COOH的速率与消耗H2O2的速率相等时,反应达到限度
B. 达反应限度时,CH3COOH、H2O2、CH3COOOH的浓度均不再变化
C. 达反应限度时,CH3COOH不再与H2O2发生反应
D. 若在反应中适当降低CH3COOH浓度,可提高反应速率
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月高考模拟化学试卷(解析版) 题型:选择题
将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是
A. 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变
B. 往溶液中滴入无色KSCN溶液,显红色
C. Fe2+和Fe3+物质的量之比为5∶1
D. 氧化产物和还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月高考模拟化学试卷(解析版) 题型:选择题
下列变化需克服相同类型作用力的是 ( )
A. 碘和干冰的升华 B. 硅和C60的熔化
C. 氯化氢和氯化钠的溶解 D. 溴和汞的气化
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月高考模拟化学试卷(解析版) 题型:选择题
在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是( )
A. CO2 B. PCl3 C. CCl4 D. H2O
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期周练(2)化学试卷(解析版) 题型:实验题
已知硫铁矿的主要成分是FeS2(铁元素呈+2价,硫元素呈—1价)。以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
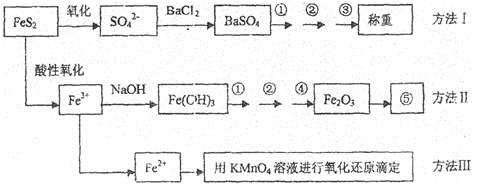
请同答下列问题:
(1)流程图中操作①、②、③分别指的是:①____________、②___________、③________。
操作④、⑤用到的主要仪器是:④_________、⑤__________(每空填1~2个仪器)。
(2)判断溶液中SO42-离子己沉淀完全的方法是______________________________________。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,需要准确配制KMnO4标准溶液,下列因素导致所配制的溶液浓度偏大的有
A.砝码生锈 | B.定容时俯视 |
C.称量时物质和砝码位置反了(需要游码) | D.容量瓶用待装液润 |
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是______________________________________。
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是_________________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期周练(2)化学试卷(解析版) 题型:选择题
化学与人们的生活、健康密切相关.下列做法不合理的是( )
A. 用米汤检验加碘食盐中的碘酸钾(KIO3)
B. 向豆浆中加入盐卤(主要成分为MgCl2)制做豆腐
C. 用灼烧和闻气味的方法区别棉织物和纯毛织物
D. 向污水中加入适量明矾,可除去其中的悬浮物
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三下学期第二次质量监测理综化学试卷(解析版) 题型:简答题
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为____________。
(2)CO2的电子式为____________,1 mol CO2分子中含有σ键的物质的量为____________。
(3)6-氨基青霉烷酸的结构如图所示:
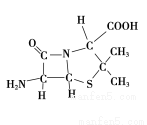
①其中C、N、O原子半径的大小关系为____________,电负性的大小关系为____________;
②其中采用sp3杂化的原子有C、____________。
(4)硝酸钾中NO3-的空间构型为____________,写出与NO3-互为等电子体的一种由前二周期元素原子构成的非极性分子化学式____________。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是____________。
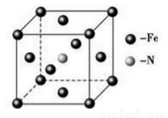
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若两个最近的Fe原子间的距离为a cm,则该晶体的密度计算式为____________g/cm3(用NA表示阿伏加德罗常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com