
| A、MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
| B、FeCl3溶液中加入Cu粉:2Fe3++3Cu=2Fe+3Cu2+ |
| C、酸性碘化钾溶液中滴加双氧水:2I-+2H++H2O2=I2+2H2O |
| D、氯化铝溶液中滴加氨水:Al3++4OH-=AlO2-+2H2O |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
| A、过氧化钠投入水中:2Na2O2+2H2O═4Na++4OH-+O2↑ |
| B、二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O |
| C、碳酸钙溶于盐酸:CO32-+2H+═H2O+CO2↑ |
| D、向氯化亚铁溶液中滴入氯水:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
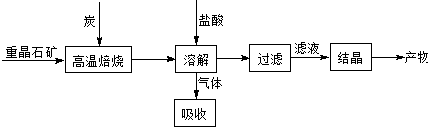
| 高温 |
| 高温 |
| c(Br-) |
| c(Cl-) |
| c(Br-) |
| c(Cl-) |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图两个装置中用滴有酚酞的NaCl溶液做电解质溶液,进行化学能和电能相互转化的研究.请回答:
如图两个装置中用滴有酚酞的NaCl溶液做电解质溶液,进行化学能和电能相互转化的研究.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I-=I2+2OH- |
| B、氯化铝溶液中滴加适量的NaF溶液:Al3++3F-+3H2O=Al(OH)3↓+3HF↑ |
| C、向CuSO4溶液中滴加氨水至过量:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+ |
D、水杨酸与足量NaHCO3溶液反应: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
| B、等物质的量浓度、等体积的Na2S与KHSO3溶液混合c (Na+)>c(K+)>c(SO32-)>c(HS-)>c(OH-)>c((H+) |
| C、在0.1mol?L-1NaHSO3溶液中有c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) |
| D、pH<7的某二元弱酸的酸式盐NaHA溶液中有c(H+)+2c(A2-)═c(OH-)+c(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb;下列有关说法正确的是(Pb的相对原子质量:207)( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb;下列有关说法正确的是(Pb的相对原子质量:207)( )| A、正极反应式:Ca+2Cl--2e-=CaCl2 |
| B、常温时,在正负极间接上电流表或检流计,指针不偏转 |
| C、放电过程中,Li+向负极移动 |
| D、每转移0.1mol电子,理论上生成20.7g Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气化反应式 | 1gK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com