
电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,若用硫酸铜溶液作电解液,粗铜接电源 极,电极反应为 ;通电一段时间后,溶液中铜离子浓度将 (增大,不变,减少)。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总离子反应
式为 ;电解时所需的精制食盐水,通常在粗盐水
加入某些试剂(现提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液来、BaCl2
溶液、Ba(NO3)2溶液、盐酸)除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,选出试剂,
按滴加的先后顺序为 (填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离
子交换膜法电解饱和食盐水原理示意图。
|
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2mol NaOH
D.向电解后的阴极溶液中加适量盐酸,可以
恢复到电解前的物质的浓度
(1)正 Cu-2e-=Cu2+; 阴 Cu2++2e-=Cu
(2)2NaCl+2H2O 2NaOH+H2↑+Cl2↑;BaCl2,Na2CO3,NaOH,HCl(Na2CO3必须放在BaCl2后,盐酸须放在最后,其他顺序可变)
(3)ABC
(1)粗铜精炼时,铜失电子,作阳极,故粗铜与电源的正极相连。由于阴极只有铜
离子析出,而阳极除了铜失电子,还有锌失电子,故溶液中铜离子浓度将少。
(2)除杂的原则是除去原有杂质,并且不引入新杂质。要除去氯化钠中含有的Ca2+、Mg2+、
Fe3+、SO42-等,除去Mg2+、Fe3+可以加入氢氧化钠,二者均生成沉淀,除去SO42-加入
过量的氯化钡,不能加入Ba(NO3)2,否则会引入硝酸根离子,加入稍过量碳酸钠,除
Ca2+和少过量的Ba2+,最后加入盐酸除去过量的碳酸根离子和氢氧根离子。
(3)由Na+移动方向判断E为阴极,产生NaOH和H2,A正确;据电解总反应式可知2NaOH—Cl2,计算C正确;D项中,应通入HCl气体,若加入盐酸会增加水的量,故D项错。


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
(10分)化学原理常应用于工业生产,如氯碱工业和硫酸工业:
(1)氯碱工业用到的设备为离子交换膜电解槽,电解时阳极加入 ___________(填试剂名称),阴极产物为_________________(填化学式),电解的总反应方程式____________________________________________________.
(2)接触法制硫酸主要分成三步,第一步是煅烧黄铁矿,在___________中进行,第二步是催化氧化,发生反应的方程式___________________________________________,
第三步是吸收三氧化硫。取制备的少量硫酸用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液的体积为400mL,放出热量为Q kJ,写出表示该反应中和热的热化学方程式___________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010年河北省高二第二学期期末考试化学试卷 题型:填空题
(10分)化学原理常应用于工业生产,如氯碱工业和硫酸工业:
(1)氯碱工业用到的设备为离子交换膜电解槽,电解时阳极加入 ___________(填试剂名称),阴极产物为_________________(填化学式),电解的总反应方程式____________________________________________________.
(2)接触法制硫酸主要分成三步,第一步是煅烧黄铁矿,在___________中进行,第二步是催化氧化,发生反应的方程式___________________________________________,
第三步是吸收三氧化硫。取制备的少量硫酸用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液的体积为400mL,放出热量为Q kJ,写出表示该反应中和热的热化学方程式___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,粗铜接电源 极,电极反应为 ;纯铜作 极,电极反应为 。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总反应化学方程式为 ;电解时所需的精制食盐水,通常在粗盐水中加入某些试剂来除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,添加试剂的先后顺序 (填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离子交换膜法电解饱和食盐水原理示意图。电极反应为:

阳极 ,
阴极 。
下列说法中正确的是
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2molNaOH
D.向电解后的阳极室溶液中加适量盐酸,可以恢复到电解前的物质的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,粗铜接电源 极,电极反应为 ;纯铜作 极,电极反应为 。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总反应化学方程式为 ;电解时所需的精制食盐水,通常在粗盐水中加入某些试剂来除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,添加试剂的先后顺序 (填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离子交换膜法电解饱和食盐水 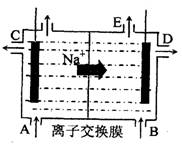 原理示意图。电极反应为:
原理示意图。电极反应为:
阳极 ,
阴极 。
下列说法中正确的是
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2mol NaOH
D.向电解后的阳极室溶液中加适量盐酸,可以恢复到电解前的物质的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com