
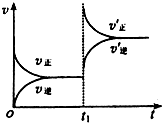
 一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.
一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.分析 (1)根据V=$\frac{△c}{△t}$计算A的平均反应速率;
(2)扩大容器体积即减小压强,反应速率减小,平衡向气体体积增大的方向移动;
(3)根据反应速率(v)与时间(t)的关系图,则t1时刻正逆反应速率都增大并且向正反应方向移动,据此分析.
解答 解:(1)若起始时A为l mol,反应2min达到平衡,A剩余0.4mol,则在0~2min内A的平均反应速率V=$\frac{△c}{△t}$=$\frac{\frac{1-0.4}{2}}{2}$=0.15mo1/(L•min),故答案为:0.15;
(2)扩大容器体积即减小压强,反应速率减小,平衡向气体体积增大的方向移动,又平衡向逆反应方向移动即为气体体积增大的方向,所以a+b>c+d,故答案为:>;减小;
(3)根据反应速率(v)与时间(t)的关系图,则t1时刻正逆反应速率都增大并且向正反应方向移动,又该反应为气体体积减小的可逆反应,所以应为升压即缩小容器体积,故选:b.
点评 本题考查化学反应速率的计算以及平衡移动的分析,题目难度不大,本题注意压强对平衡的移动原理.


科目:高中化学 来源: 题型:多选题
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率降低了 | ||
| C. | C为气态 | D. | C为固态或液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2LCO和2LCO2 | B. | 标准状况下22.4LH2O和1mol O2 | ||
| C. | 0,4克H2和4.48L HCl | D. | 18克水和标准状况下22.4L CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 0 min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com