
下列变化中起氧化作用和还原作用的元素不是同一种元素的是( )
| A.在400 ℃左右且有催化剂存在的条件下,用氨气把一氧化氮还原为氮气 |
| B.工业上用稀硫酸和氧气与单质铜反应制取硫酸铜 |
| C.工业上用石灰乳和氯气制备漂白粉 |
| D.实验室用氯酸钾和浓盐酸制取氯气 |
 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:填空题
Ⅰ.2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。汽车尾气净化的主要原理为:2NO(g)+2CO(g)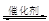 2CO2(g) +N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2CO2(g) +N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。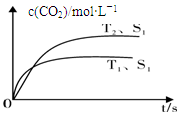
据此判断:
(1)该反应的ΔH 0(选填“>”、“<”)。
(2)若在一定温度下,将1.0 mol NO、0.5 mol CO充入0.5 L固定容积的容器中,达到平衡时NO、CO、CO2、N2物质的量分别为:0.8 mol、0.3 mol、0.2 mol、0.1 mol,该反应的化学平衡常数为K= ;若保持温度不变,再向容器中充入CO、N2各0.3 mol,平衡将 移动(选填“向左”、“向右”或“不”)。
Ⅱ.以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。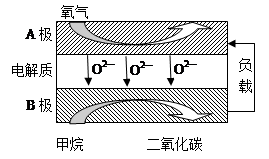
回答下列问题:
(1)B极为电池 极,电极反应式为 。
(2)若用该燃料电池做电源,用石墨做电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下)。
Ⅲ.FeS饱和溶液中存在:FeS(s) Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为 。
Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。 请回答下列问题:
(1)B的原子结构示意图 。
(2)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子);由A、B、C三种元素按4∶2∶3组成的化合物所含的化学键类型为 。
(3)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(4)在100 mL 18 mol/L的浓的A、C、E组成的酸溶液中加入过量的铜片,加热使之充分反应, 产生的气体在标准状况下的体积可能是 (填序号);
a.7.32 L b.6.72 L c.20.16 L d.30.24 L
若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为: 。
(5)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式为 ,用该电池电解1 L 1 mol/L NaCl溶液当消耗标准状况下1.12 L H2时,NaCl溶液的pH= (假设电解过程中溶液的体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知 2Na2O2+2CO2=2Na2CO3+O2,因此Na2O2可在呼吸面具和潜水艇里作供氧剂。
(1)请在答卷上用双线桥法标出上述方程式的电子转移方向和数目。
(2) 是还原剂, 是还原产物。
(3)若转移3mol电子,则所产生的氧气在标准状况下的体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式: 
(2)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为 。
(3)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表: 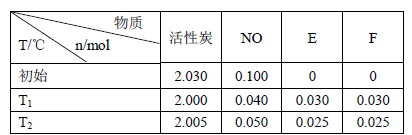
上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= 。
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。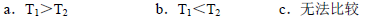
(4)CO2经常用氢氧化钠来吸收,现有0.4 molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在 650 ℃下工作的燃料电池,其负极反应式: 则
则
正极反应式:___ ,电池总反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
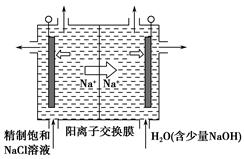
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____________。
(2)该反应中发生氧化反应的物质是__________,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(3)48.0 g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4 L气体(标准状况下),反应中消耗HNO3的物质的量可能是( )
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质: FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3 + ______  ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并写出配平后的离子方程式:_________________________。
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念——“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是( )
A.Cu  Cu(NO3)2
Cu(NO3)2
B.Cu 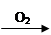 CuO
CuO Cu(NO3)2
Cu(NO3)2
C.Cu 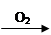 CuO
CuO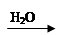 Cu(OH)2
Cu(OH)2 Cu(NO3)2
Cu(NO3)2
D.Cu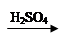 CuSO4
CuSO4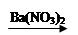 Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | 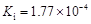 |  | 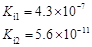 | 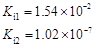 |
 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O ,试配平上述化学方程式。
,试配平上述化学方程式。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ,ΔH=—76.0 kJ·mol-1,该反应中每放出38 kJ热量,转移电子的物质的量为 mol.
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO20.2mol·L—1,H20.8mol·L—1, CH40.8mol·L—1,H2O1.6mol·L—1,起始充CO2和H2的物质的量分别为 、 。CO2的平衡转化率为
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充人1 mot CO2,和4 molH2,在II中充人1 mol CH4和2 mol H2 O(g) , 300℃下开始反应。达到平衡时,下列说法正确的是 (填字母)。
| A.容器I、II中正反应速率相同 |
| B.容器I、II中CH4的物质的量分数相同 |
| C.容器I中CO2的物质的量比容器II中的多 |
| D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com