
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: Ⅰ:C(s)+H2O(g)═CO(g)+H2(g) K1 Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)K2 Ⅲ:CaO(s)+CO2(g)═CaCO3(s)K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)═CO2(g) △H=-393.8kJ•mol-1 V:CaCO3(s)═CaO(s)+CO2(g) |
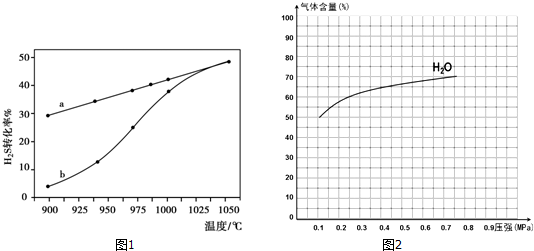
分析 (1)①根据温度升高,H2S转化率增大,可知化学平衡正向移动,化学平衡移动原理可知升温平衡吸热反应方向进行,向据此分析;
②根据转化率求出H2S的反应的量,再求反应速率v=$\frac{△c}{△t}$;
③根据温度对速率的影响分析,温度越高反应速率越大;
(2)①反应I、II、III之和为反应C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g),据此分析平衡常数的关系,固体不能写入表达式;
②根据方程式确定CO与H2O变化量关系,根据图中H2O含量来确定CO的含量,反应中H2O的变化量约等于CO的变化量,当起始水的含量为50%,则H2、CO各占25%,则CO的曲线的起点坐标为(0.1,25),平衡时水的含量为70%,则H2、CO各占15%,H2O含量变化与CO含量变化关于含量y=37.5的直线对称,据此分析;
③提高H2产量,则需使平衡正向移动,根据影响平衡的因素分析,
A.该反应为放热反应,降低体系的温度;
B.该反应前后气体体积不变,使各气体组分浓度均加倍,则压强增大,平衡不移动;
C.适当增加水蒸气的通入量,平衡正移;
D.增加固体CaO的量,对平衡无影响;
(3)方法二CaO能循环使用,降低能耗据此分析.
解答 解:(1)①由图象可知,温度升高,转化率增大,则平衡正移,所以正方向为吸热方向,即△H>0,故答案为:>;
②H2S的起始浓度均为c mol•L-1,若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为c mol•L-1×40%=0.4cmol•L-1,
v=$\frac{△c}{△t}$=$\frac{0.4c}{t}$mol•L-1•min-1;
故答案为:$\frac{0.4c}{t}$mol•L-1•min-1;
③随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;
故答案为:温度升高,反应速率加快,达到平衡所需时间缩短;
(2)①已知:I:C(s)+H2O(g)═CO(g)+H2(g) K1
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)K2
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)K3
反应I、II、III之和为反应C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g),则K=K1•K2•K3;
故答案为:K1•K2•K3;
②反应中H2O的变化量约等于CO的变化量,当起始水的含量为50%,则H2、CO各占25%,则CO的曲线的起点坐标为(0.1,25),平衡时水的含量为70%,则H2、CO各占15%,H2O含量变化与CO含量变化关于含量y=37.5的直线对称,故图中CO的变化曲线示意图为: ,
,
故答案为: ;
;
③提高H2产量,则需使平衡正向移动,已知C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g),△H=-87.9kJ•mol-1;
A.该反应为放热反应,降低体系的温度,平衡正移,则能提高H2产量,故A正确;
B.该反应前后气体体积不变,使各气体组分浓度均加倍,则压强增大,平衡不移动,所以H2产量不变,故B错误;
C.适当增加水蒸气的通入量,平衡正移,则能提高H2产量,故C正确;
D.增加CaO的量,对平衡无影响,所以H2产量不变,故D错误;
故答案为:AC;
(3)方法二中实现了吸收剂CaO的循环,降低能耗,降低了生产成本,故答案为:实现了吸收剂CaO的循环,降低能耗.
点评 本题考查反应热的判断、反应速率的计算、化学平衡图象与影响因素等,难度中等,注意把握图象中坐标的含义,充分利用图象中的信息,题目综合性强,侧重于考查学生对所学知识的应用能力.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中 Mg2+、Al3+、SO42-、CO32- | |
| B. | pH=1的溶液中 NH4+、Ba2+、HCO3-、NO3- | |
| C. | 含MnO4-的溶液中 H+、K+、Br-、I- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中 Na+、K+、CH3COO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3跟稀硝酸反应 | B. | Al(OH)3跟稀硝酸反应 | ||
| C. | CuO跟稀硝酸反应 | D. | Fe(OH)2跟稀硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的名称为2,3-二甲基戊烷 的名称为2,3-二甲基戊烷 | |
| B. | 18.0g的葡萄糖与乳酸[CH3CH(OH)COOH]混合物完全燃烧消耗氧气13.44L | |
| C. | 结构片段为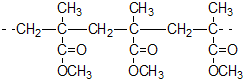 的高聚物,是通过加聚反应生成的 的高聚物,是通过加聚反应生成的 | |
| D. | 化合物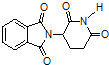 在氢氧化钠溶液中加热后有NH3生成 在氢氧化钠溶液中加热后有NH3生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中,钢铁制品和铝制品都容易发生吸氧腐蚀 | |
| B. | 聚乙烯塑料易老化,是因为发生了加成反应 | |
| C. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 | |
| D. | 空气质量指标中有一项指标名称为PM2.5,指的是空气中直径≤2.5微米的固体或液体的总称 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com