
| A、碳酸钙受热分解 |
| B、乙醇燃烧 |
| C、氢气还原氧化铜 |
| D、氧化钙溶于水 |


科目:高中化学 来源: 题型:
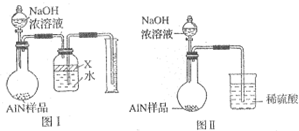
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol H2O所含有的原子数为NA |
| B、常温常压下,32g O2含有的氧原子数为2NA |
| C、常温常压下,11.2L Cl2所含的分子数为0.5NA |
| D、1L 0.1mol/L Na2SO4溶液中所含的Na+为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低温度 | B、升高温度 |
| C、减小压强 | D、加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Y<Z<W |
| B、气态氢化物的稳定性:Y<W |
| C、X与Y只能形成一种化合物 |
| D、Z2WY3可用来制备木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com