
X、Y、Z、M、N是五种短周期元素,原子序数依次增大。X原子中没有中子,Y元素最高正价与最低负价之和为0;M与X同主族;Z、N分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) ,M离子的电子排布式为 。
由以上某些元素组成的化合物A、B、C、D有如下转化关系

其中C是溶于水显酸性的气体;D是淡黄色固体。
(3)写出C的结构式 ;D的电子式
(4)如果A、B均由三种元素组成,B为两性不溶物,写出由A转化为B的离子方程式
(5)如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因 。
(6)如果将27题中A、B浓度均为0.1mol/L的溶液混合,混合溶液中离子浓度由大到小的顺序是 。
(1)原子半径大小顺序为Na>Al>C>O>H (2分)
(2)C2H2 1S22S22P6 (各1 分,共2分)
(3)O=C=O,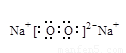 (各1 分,共2分2分)
(各1 分,共2分2分)
(4)AlO2-+2H2O+CO2→Al (OH)3↓+HCO3-或2 AlO2-+3 H2O+CO2→2 Al(OH)3↓+CO32-
(2分)
(5)CO32-+H2O HCO3-+OH-, (2分)
HCO3-+OH-, (2分)
(6)c(Na+)> c(HCO3-) >c(CO32-)> c(OH-)> c(H+)。(2分)
【解析】
试题分析:X原子中没有中子,是氢;Y元素最高正价与最低负价之和为0,是碳;M与X同主族,M是钠;Z、N分别是地壳中含量最高的非金属元素和金属元素,分别是氧和铝。X、Y、Z、M、N是五种短周期元素,分别为H,C,O,Na,Al。
(1)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Na>Al>C>O>H,故答案为:Na>Al>C>O>H;
(2)H与C形成多种化合物,属于烃类物质,其中既含极性键又含非极性键,且相对分子质量最小是C2H2,故答案为:C2H2;M离子的电子排布式为1S22S22P6。
(3)CO2的结构式为O=C=O,Na2O2的电子式为 。
。
(4)①如果A、B均由三种元素组成,B为两性不溶物,结合转化关系可知,A为偏铝酸钠、B为氢氧化铝,偏铝酸根与二氧化碳、水反应生成氢氧化铝与碳酸根,反应离子方程式为:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,故答案为:NaAlO2;2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-;
(5)如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,结合转化关系可知,A为碳酸钠、B为碳酸氢钠,溶液中碳酸根水解CO32-+H2O⇌HCO3-+OH-,破坏水的电离平衡,溶液呈碱性;
(6)碳酸钠、碳酸氢钠均为0.1mol•L-1的混合溶液中,钠离子浓度最大,碳酸根、碳酸氢根水解,溶液呈碱性,碳酸根的水解程度大于碳酸氢根,故离子浓度由大到小的顺序是c (Na+)>c (HCO3-)>c (CO32-)>c (OH-)>c (H+);
考点:本题考查了结构性质位置关系、常用化学用语、无机推断、盐类水解等,难度中等。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2014届江苏省高一第二学期期中考试化学试卷(解析版) 题型:选择题
X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增。已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大。Z和N可以形成ZN2型化合物。下列有关说法正确的是
A.X与Y只能形成一种化合物 B.最高价氧化物对应水化物的碱性: Y>Z
C.气态氢化物的稳定性:M>N D.单质的氧化性:X<M
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏南通小海中学高一下学期期中考试化学试卷(解析版) 题型:选择题
X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增。已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大。Z和N可以形成ZN2型化合物。下列有关说法正确的是( )
A.X与Y只能形成一种化合物 B.最高价氧化物对应水化物的碱性:Y>Z
C.气态氢化物的热稳定性:M>N D.单质的氧化性:X<M
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com