
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源:2017届河北邯郸市高三上学期第二次月考化学试卷(解析版) 题型:选择题
有一瓶Na2SO3溶液,可能部分被氧化,某同学进行如下实验:取少量此溶液,滴入Ba(NO3)2溶液产生白色沉淀,再加入足量稀HCl,充分振荡后仍有白色沉淀,对此实验下列结论正确的是( )
A.加HCl后的不溶沉淀一定为BaSO4
B.此溶液中Na2SO3已部分氧化
C.加入Ba(NO3)2溶液生成的沉淀一定含BaSO4
D.此样品未被氧化
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上学期10月月考化学试卷(解析版) 题型:实验题
重铬酸钾是一种常见的强氧化剂。实验室以精选铬铁矿(主要成分可表示为FeO.Cr2O3,还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾晶体(K2Cr2O7,式量294)的流程如下:
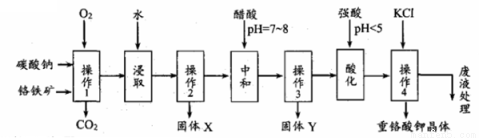
请回答下列问题:
⑴操作1中发生的反应有:
4FeO·Cr2O3 + 8Na2CO3 + 7O2 = 8Na2CrO4 + 2Fe2O3 + 8CO2↑
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑
Na2CO3 + SiO2 = Na2SiO3 + CO2↑
该步骤在常温下的反应速率较慢,为使反应速率增大,可采取的措施是 (写出两条)
⑵固体Y中主要含有 。(填写化学式)
⑶酸化步骤使含铬物质发生了转化为_________,请写出离子反应方程式 。
⑷操作4中的化学反应在溶液中能发生的可能理由是 ,获得晶体的操作依次是:加入KCl固体,在水浴上加热浓缩至 ,冷却结晶,抽滤、洗涤、干燥。
⑸通过下列实验可测定产品中重铬酸钾的质量分数:
称取重铬酸钾试样1.470g,用100mL容量瓶配制成溶液。移取25.00mL溶液于碘量瓶中,加入适量稀硫酸和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/L Na2S2O3标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:
I2 + 2S2O32- = 2I- + S4O62-
则所测定产品中重铬酸钾的纯度为 。
⑹有关上述实验过程中涉及的部分实验操作的描述,正确的是 。
A.粗产品若要进一步提纯,可以采用重结晶的方法
B.配制溶液时,用托盘天平称取试样后,一般经溶解、转移(含洗涤)、定容等步骤,配制成100mL溶液
C.滴定时,当最后一滴标准溶液滴入时,溶液变为蓝色,且半分钟内不变色,可判断滴定终点
D.滴定终点时俯视读数,测定结果偏低
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.氯化铁腐蚀铜板:Fe3+ + Cu = Fe2+ + Cu2+
B.实验室制氯气:MnO2 + 4HCl(浓)  Mn2+ + 2Cl2↑ + 2H2O
Mn2+ + 2Cl2↑ + 2H2O
C.稀硫酸中加氢氧化钡到溶液呈中性:Ba2+ +H+ + OH- + SO42- = BaSO4↓+ H2O
D.氢氧化钠溶液中吸收少量二氧化硫:2OH- + SO2 = SO32- + H2O
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列物质的水溶液因水解呈碱性的是
A.NH4Cl B.MgSO4 C.KOH D.NaClO
查看答案和解析>>
科目:高中化学 来源:2017届西藏自治区拉萨中学高三上第一次月考化学卷(解析版) 题型:填空题
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。
(1) 写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+ 6H2(g)+ O2(g)== 2CH3OCH3(g)的反应热为 ;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+ 2CO2(g) CH3OCH3(g)+ 3H2O(g) △H<0
CH3OCH3(g)+ 3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡 状态的是 (选填编号,注意大小写)
状态的是 (选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将 (填“变大”、“变小”或“不变”)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式的其中一个产物是CO32-,请写出该反应的负极反应式 ;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500 mL NaCl溶液,装置如图所示:
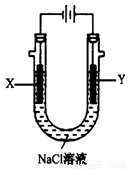
请写出电解过程中Y电极附近观察到的现象是 ;当燃料电池消耗2.8 LO2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
查看答案和解析>>
科目:高中化学 来源:2017届西藏自治区拉萨中学高三上第一次月考化学卷(解析版) 题型:选择题
下列叙述正确的是
A.SO2具有还原性,故可作漂白剂
B.Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中Fe也显+3价
查看答案和解析>>
科目:高中化学 来源:2017届陕西省西安市高三上学期10月月考化学试卷(解析版) 题型:填空题
Na2O与水反应的化学方程式为 ,该反应 (填“是”或“不是”)氧化还原反应。制Na2O通常采用的方法是:2NaNO2+6Na == 4Na2O+N2↑,不采用钠在氧气中燃烧而采用此法是因为 。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:推断题
[化学――选修5:有机化学基础]添加塑化剂可改善白酒等饮料的口感,但不应超过规定的限量。DBP是一种酯类塑化剂,可由下列路线合成:

已知以下信息:
①
② (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)
(1)A的结构简式 ,D的结构简式是 ,D→E的反应类型 ;
(2)D和H2 1︰1反应生成E,则E官能团名称为_________,DBP的分子式为 ;
(3)由B和E以物质的量比1︰2合成DBP的化学方程式: ;
(4)写出2种同时符合下列条件的B的分异构体结构简式 ;
①能和NaHCO3溶液反应生成CO2
③能使FeC13溶液发生显色反应
②能发生银镜反应
④苯环上含碳基团处于对位
(5)写出B与碳酸氢钠溶液反应的方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com