
| 模拟尾气 | 气体 | 碳烟 | ||
| NO | O2 | He | ||
| 物质的量分数或物质的量 | 0.25% | 5% | 94.75% | a mol |
分析 (1)①2Co(s)+O2(g)═2CoO(s)△H1=akJ•mol-1;②2CoCO3(s)═CoO(s)+CO2 (g)△H2=akJ•mol-1;根据盖斯定律,则反应2Co(s)+O2(g)+2CO2(g)═2CoO3(s) 的△H=△H1-2△H2;
(2)①原电池中,负极发生氧化反应,阳离子向正极移动;
②LiCoO2中的Co是+3价,变成CoSO4中的Co是+2价,所以LiCoO2是氧化剂,则是H2O2是还原剂,由此书写反应的化学方程式;
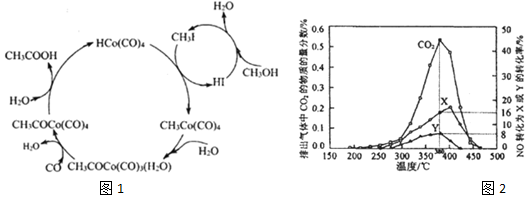
(3)由图1可知右边下面进去1mol的水,而上面又出来1mol的水,所以实际反应的是甲醇;左边上面进去1mol的水,而下面又出来1mol的水,参与反应的是一氧化碳,而生成的醋酸,由此书写总的反应方程式;
(4)①模拟尾气中一氧化氮的物质的量为:0.25%×10mol=0.025mol,而图中参与反应生成X和Y的一氧化氮的物质的量为:0.025mol×(8%+16%)=0.006mol,模拟尾气中O2的物质的量为:10mol×5%=0.5mol,测得排出的气体中含0.45 mol O2,说明实际参与反应的氧气的物质的量为0.05mol,同时测得0.0525 mol CO2,根据氧守恒,可知氧化二氮的物质的量为:0.05×2+0.006-0.0525×2=0.001mol,根据氮守恒可知氮气的物质的量为:$\frac{0.006-0.001×2}{2}$=0.002mol,所以16%对应的是氮气,而8%对应是氧化二氮;
②二氧化氮与四氧化二氮之间存在双聚平衡,所以无纯的二氧化氮,由此分析解答.
解答 解:(1)①2Co(s)+O2(g)═2CoO(s)△H1=akJ•mol-1;②2CoCO3(s)═CoO(s)+CO2 (g)△H2=akJ•mol-1;根据盖斯定律,则反应2Co(s)+O2(g)+2CO2(g)═2CoO3(s) 的△H=△H1-2△H2=(a-2b)kJ•mol-1,故答案为:(a-2b)kJ•mol-1;
(2)①原电池中,负极发生氧化反应,电极反应式为:LiC6-e-═Li++C6,阳离子向正极移动,故答案为:LiC6-e-═Li++C6;正极;
②LiCoO2中的Co是+3价,变成CoSO4中的Co是+2价,所以LiCoO2是氧化剂,则是H2O2是还原剂,则化学方程式为:2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+4H2O+O2↑,故答案为:2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+4H2O+O2↑;
(3)由图1可知右边下面进去1mol的水,而上面又出来1mol的水,所以实际反应的是甲醇;左边上面进去1mol的水,而下面又出来1mol的水,参与反应的是一氧化碳,而生成的醋酸,所以总反应的方程式为:CO+CH3OH→CH3COOH,故答案为:CO+CH3OH→CH3COOH;
(4)①模拟尾气中一氧化氮的物质的量为:0.25%×10mol=0.025mol,而图中参与反应生成X和Y的一氧化氮的物质的量为:0.025mol×(8%+16%)=0.006mol,模拟尾气中O2的物质的量为:10mol×5%=0.5mol,测得排出的气体中含0.45 mol O2,说明实际参与反应的氧气的物质的量为0.05mol,同时测得0.0525 mol CO2,根据氧守恒,可知氧化二氮的物质的量为:0.05×2+0.006-0.0525×2=0.001mol,根据氮守恒可知氮气的物质的量为:$\frac{0.006-0.001×2}{2}$=0.002mol,所以16%对应的是氮气,而8%对应是氧化二氮,即Y对应是N2O,故答案为:N2O;
②二氧化氮与四氧化二氮之间存在双聚平衡,所以无纯的二氧化氮,故答案为:NO较NO2稳定,NO2气体中存在N2O4,不便于定量测定.
点评 本题考查盖斯定律、电化学和图象问题,综合性强,有一定的难度,特别是(4)中一氧化氮并未完全参与反应,然后运用原子守恒分析解答.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题

| 酸 | HClO2 | H2CO3 | HClO |
| Ka | 1×10-2 | K1=4.3×10-7、K2=5.6×10-11 | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl可用作食品调味剂 | |
| B. | 相同温度下NaHCO3溶解度大于Na2CO3 | |
| C. | Na2CO3的焰色反应呈黄色 | |
| D. | 工业上Na可用于制备钛、锆等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学性质 | 实际应用 |
| A | ClO2具有强氧化性 | 自来水消毒杀菌 |
| B | SO2具有还原性 | 用作漂白剂 |
| C | NaHCO3受热易分解并且生成气体 | 焙制糕点 |
| D | Al(OH)3分解吸收大量热量并有H2O生成 | 阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .正常条件下,pH值小于5.6的降雨是“酸雨” | |
| B. | 冰岛火山喷发含有大量SO2,在局部区域形成酸雨 | |
| C. | 全球“低碳”行动能减少CO2排放量,也就能降低酸雨的形成及危害 | |
| D. | 汽车尾气含有氮氧化合物,过量排放形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
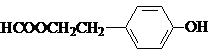 (写结构简式).
(写结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com