
分析 (Ⅰ)二氧化碳可导致温室效应,二氧化硫可导致酸雨,氟氯烃可导致臭氧空洞,以此解答;
(Ⅱ)(1)正常雨水的pH为5.6,低于5.6的为酸雨;
(2)由表中数据可知,随着时间的延长,pH逐渐减小,酸性逐渐增强,由于排放出来的SO2等气体溶于水后生成H2SO3,H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的H2SO4,从而使雨水的酸性增强;
(Ⅲ) 汽油燃烧以后会对环境造成污染,而甲醇完全燃烧后生成CO2和H2O,产物对环境不会造成污染.
解答 解:(Ⅰ)造成酸雨的主要因素是二氧化硫的含量增加,全球气候变暖是由于二氧化碳的含量的急剧增加,导致温室效应,而造成臭氧空洞的主要物质是氟氯烃,释放出的卤素元素为臭氧分解的催化剂,导致臭氧层稀薄,
故答案为:②;①;③;
(Ⅱ)(1)正常雨水的pH为5.6,测得该雨水样品的pH为4.73,小于5.6,为酸雨,
故答案为:是;该雨水pH<5.6;
(2)亚硫酸为弱酸,硫酸为强酸,由表中数据可知,随着时间的延长,pH逐渐减小,酸性逐渐增强,由于排放出来的SO2等气体溶于水后生成H2SO3,H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的H2SO4,2H2SO3+O2=2H2SO4,从而使雨水的酸性增强,
故答案为:增强;2H2SO3+O2=2H2SO4;
(Ⅲ) 汽油、柴油、重油属于化石燃料中的石油,燃烧时产生有害气体,污染空气,如产生的氮氧化物是形成光化学烟雾的成分,甲醇燃烧的产物只有CO2和H2O,不会造成污染,
故答案为:D.
点评 本题考查环境污染知识,侧重于元素化合物知识的综合考查和运用,为高频考点,有利于培养学生的环境意识和学习的积极性,注意酸雨的形成原理和酸雨的类型,题目难度不大.


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验试液中的SO42-:试液$\stackrel{足量稀硝酸}{→}$无沉淀$\stackrel{BaCl_{2}溶液}{→}$白色沉淀 | |
| B. | 除去乙酸乙酯中混有的乙酸:混合液$\stackrel{饱和碳酸钠溶液}{→}$$\stackrel{振荡}{→}$溶液分层$\stackrel{分液}{→}$得上层液体 | |
| C. | 证明酸性条件下H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液}{→}$$\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 鉴定盐A的成分是FeBr3: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
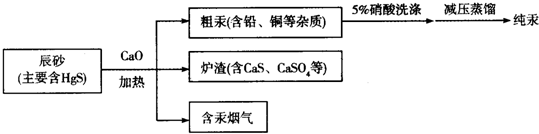
| A. | 流程中加入氧化钙的目的是减少SO2的排放 | |
| B. | “辰砂”加热时发生反应:HgS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+SO2,该方法属于热分解法 | |
| C. | 洗涤粗汞时可用5%的盐酸代替5%的硝酸 | |
| D. | 含汞烟气中汞的含量很低,可以直接排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
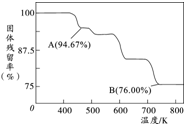 铬元素及其化合物在生产、生活中具有广泛的用途.
铬元素及其化合物在生产、生活中具有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂盐 | B. | 钠盐 | C. | 钙盐 | D. | 铜盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com