
【题目】下列指定反应的离子方程式正确的是
A.向NaOH溶液中通入过量CO2:2OH-+CO2=CO32-+H2O
B.电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.向H2O2溶液中加入MnO2:2H2O2+4H++MnO2=O2↑+Mn2++4H2O
D.向KAl(SO4)2溶液中滴加Ba(OH)2溶液至SO42—沉淀完全:Al3++2SO42—+2Ba2++4OH—=AlO2-+2BaSO4↓+2H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用下列装置制备漂白粉,下列说法不正确的是( )
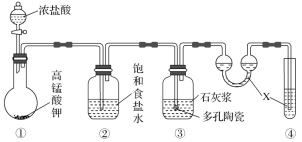
A.装置④中的X试剂为NaOH溶液
B.装置②中饱和食盐水的作用是除去Cl2中的HCl
C.装置③中的石灰浆可以用石灰水代替
D.制备漂白粉的反应是放热反应,温度较高时有副反应发生,可以将装置③放在冷水中
查看答案和解析>>
科目:高中化学 来源: 题型:
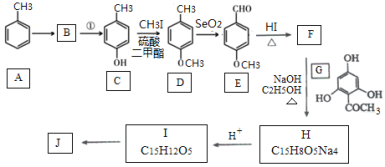
【题目】根皮素J(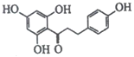 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
已知:
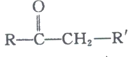 +R’’CHO
+R’’CHO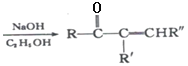 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中的官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应条件___________.
(3)写出由C生成D和由D生成E的反应类型___________、___________.
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
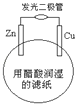
A. 铜片上的电极反应:Cu — 2e﹣ = Cu2+
B. 锌片为电池的负极
C. 外电路中电子由铜片经导线流向锌片
D. 电池工作时电能直接转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理汽车尾气和燃煤尾气是环境保护的重要课题.请回答下列问题:
(1)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g).在恒容密闭容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示.
2CO2(g)+N2(g).在恒容密闭容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示.
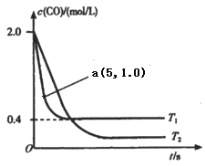
①据此判断该反应的正反应为____(填“放热”或“吸热”)反应.
②温度T1时,该反应的平衡常数K=_____;反应速率v=v(正)-v(逆)=k正c2(NO)c2(CO)- k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处v(正):v(逆)=________.
(2)下图流程是一种新型的除去尾气中氮氧化物的技术,一般采用氨气或尿素作还原剂
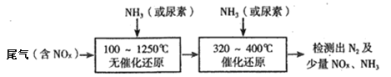
该技术中用尿素[CO(NH2)2]作还原剂还原NO2的主要反应为:4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O ,则用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)的化学方程式为:______.
4CO2+7N2+8H2O ,则用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)的化学方程式为:______.
(3)哈伯法合成氨的流程图如图,下列五个流程中为提高原料利用率而采取的措施________(填序号)
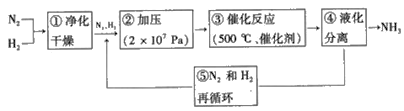
(4)一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+.下列叙述正确的是______________(填选项)
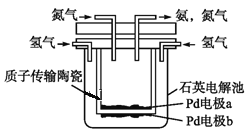
A.Pd电极b为阴极 B.阴极的反应式为N2+6H++6e-=2NH3
C.H+由阳极向阴极迁移 D.陶瓷可以隔离N2和H2
(5)也可用CH4催化还原NOx法消除烟气中氮氧化物的污染.已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.0 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则CH4催化还原NO的热化学方程式为__________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
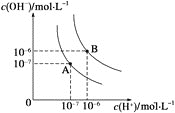
【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)________mol·L-1,Kw(25 ℃)________Kw(100 ℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_____________________________。
②25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)______c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Na2SO3、Na2S04混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A. 将样品配制成溶液V1L,取其中25.00 mL用标准KMn04溶液滴定,消耗标准 KMn04 溶液V2 mL
B. 向样品中加足量H202,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg
C. 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g
D. 将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHS03的洗气瓶、盛有浓H2S04的洗气瓶、盛有碱石灰的干燥管I、盛有碱石灰的干燥管II,测得干燥管I增重dg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A. 增大容器容积B. 升高反应温度
C. 分离出部分氢气D. 等容下通入惰性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学常见物质且均含有同一种元素,它们之间的部分转化关系如图所示(反应条件及其他物质已经略去):A![]() B
B![]() C
C![]() D。
D。
(1)若A为淡黄色固体单质,且D为强酸。
①B物质通常用______(填试剂名称)来检验。
②从组成物质的元素化合价变化角度预测B可能具有的性质____,并用相应的化学方程式表示你预测的性质________。
③一定条件下D转化为B有多种途径,写出其中一种D![]() B转化的化学方程式___________________。
B转化的化学方程式___________________。
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,D的稀溶液能使湿润的蓝色石蕊试纸变红。
①写出实验室制取A的化学方程式_________。
②B、C都是大气污染物,它们对环境造成的危害表现在_____。
a 引起酸雨 b 引起温室效应
c 形成光化学烟雾 d 引起水体富营养化
③写出C![]() D转化的离子方程式_________________。
D转化的离子方程式_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com