
【题目】(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
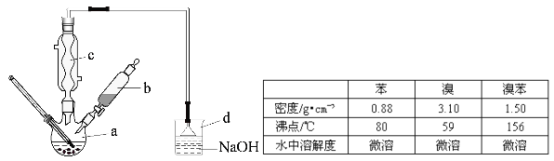
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25mL B. 50mL C.250mL D.500mL
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】四个体积相同的密闭容器中,在一定条件下发生反应:反应开始时,反应速率最大的是
容器 | 温度 | N2(mol) | H2(mol) | 催化剂 |
A | 500 | 2 | 6 | 有 |
B | 500 | 1.5 | 4.5 | 无 |
C | 450 | 1.5 | 4.5 | 无 |
D | 450 | 2 | 6 | 无 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)甲基的电子式___________。
(2)写出由丙烯制备聚丙烯的化学反应方程式_______________________。
(3)反式2 -丁烯的结构简式______________________________
(4)与H2加成生成2,5 - 二甲基己烷的炔烃的系统命名___________________________
(5)![]() 的系统命名_____________________________________。
的系统命名_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.乙烯是一种重要的化工原料。根据下列转化关系回答:

(1)乙烯分子中官能团的名称是___________。
(2)![]() 的分子式是____________。
的分子式是____________。
(3)乙烯转化成A的化学方程式是_________________。反应类型是______。
II.乙烯在化工生产领域应用广泛。
以原油为起始原料合成聚乙烯的路线如下图所示。

(1)反应III的化学方程式:__________。反应类型是________。
(2)写出分子式符合C4H10的所有物质的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
①、  此键线式所表示有机物的结构简式是:________________;
此键线式所表示有机物的结构简式是:________________;
②、 此有机物的系统命名为:________________;
此有机物的系统命名为:________________;
③、 ![]() 此有机物用系统命名法的名称是:________________;
此有机物用系统命名法的名称是:________________;
④、写出结构简式: 2,2-二甲基-3-乙基己烷________________;
⑤、写出结构简式: 2-甲基-2-丁烯________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电子式书写正确的是( )
①钠离子[Na]+ ②过氧根离子![]() ③氢氧根离子
③氢氧根离子![]()
④氧原子![]() ⑤氢离子H+ ⑥铵根离子
⑤氢离子H+ ⑥铵根离子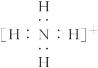
⑦铝原子Al ⑧溴离子![]()
A. ②③④⑥⑦B. ①③④⑥⑦⑧
C. ③④⑤⑥⑧D. ②③④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:

已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有____。
a.适当升高温度 b.搅拌 c.加适量纯碱 d.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是__________________________。
(3)调节pH为5.4~5.8的目的是______________。
(4)滤渣3的主要成分的化学式是_______。
(5)采用50℃碳化的原因是_________________________________。该过程发生反应的离子方程式是__________________。
(6)检验碳酸锰产品完全洗净的方法是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:锂离子电池的总反应为LixC+Li1-xCoO2![]() C+LiCoO2,锂硫电池的总反应为2Li+S
C+LiCoO2,锂硫电池的总反应为2Li+S![]() Li2S。有关两种电池说法正确的是 ( )
Li2S。有关两种电池说法正确的是 ( )
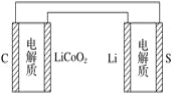
A. 锂离子电池放电时,Li+向负极迁移
B. 当锂硫电池充电时,硫电极发生氧化反应
C. 理论上两种电池的电极材料单位质量相同时释放的电能相同
D. 上图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用乙醇与浓硫酸的混合液加热的方法制取乙烯。反应中常因温度而发生副反应。请选用下列装置(装置可以使用多次)完成相关实验并回答有关问题:
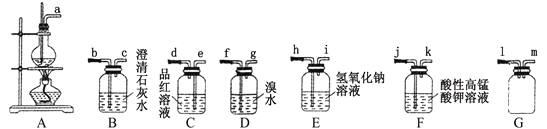
(1)制备乙烯时,常在A装置的烧瓶中加入碎瓷片,其目的是______________________;加热时要使溶液的温度迅速上升到140℃以上,因为在140℃左右易生成乙醚,该有机物的结构简式为_____________;生成乙烯的化学方程式为_____________________。
(2)乙醇与浓硫酸加热制取乙烯时,乙烯气体中常混有SO2和 CO2,为验证有副产物SO2和 CO2气体存在,上述仪器的连接顺序为a→_________________________________。
(3)某同学设计制备1,2-二溴乙烷的装置连接顺序为A→E→C→D。已知1,2-二溴乙烷的主要物理性质有:难溶于水、熔点9℃、沸点132℃、密度2.2 g·cm-3。
①E装置的作用_________________________;
②分离D装置中1,2-二溴乙烷的操作方法是加入试剂_______________ ,充分反应后进行______________操作。
③反应过程中,应将D装置放在10℃的水浴中,温度不宜过低、过高的原因是__________________________________________________。
(4)请设计验证酸性高锰酸钾溶液能将乙烯氧化为CO2的实验方案。装置连接顺序为A→_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com