
 ,
,分析 A、B、C、D是原子序数依次增大的四种短周期元素,D单质在空气中燃烧生成淡黄色的固体,则D为Na;B、C一定处于第二周期,而A原子是半径最小的原子,且原子序数最小,则A不可能与B、C处于同周期,A、B、C的单质常温下为气体,则A为H元素;元素B和D可以形成D3B型和DB3型化合物,则B为N元素;元素C和A可以形成常见化合物甲和乙,化合物乙具有强氧化性,则C为O元素,甲为H2O,乙为H2O2,据此解答.
解答 解:A、B、C、D是原子序数依次增大的四种短周期元素,D单质在空气中燃烧生成淡黄色的固体,则D为Na;B、C一定处于第二周期,而A原子是半径最小的原子,且原子序数最小,则A不可能与B、C处于同周期,A、B、C的单质常温下为气体,则A为H元素;元素B和D可以形成D3B型和DB3型化合物,则B为N元素;元素C和A可以形成常见化合物甲和乙,化合物乙具有强氧化性,则C为O元素,甲为H2O,乙为H2O2.
(1)乙为H2O2,其电子式为 ,故答案为:
,故答案为: ;
;
(2)Na3N属于离子晶体,该化合物溶于水发生反应:Na3N+4H2O═3NaOH+NH3•H2O,所得到溶液呈碱性,故答案为:离子化合物;碱性;Na3N+4H2O═3NaOH+NH3•H2O;
(3)化合物NaN3中含有N3-离子,已知N3-离子和CO2分子具有相同的电子数,称为等电子体,等电子体具有相似的结构,N3-离子中N原子之间形成2对共用电子对,则N3-的结构式为:[N=N=N]-,故答案为:[N=N=N]-.
点评 本题考查结构性质位置关系应用,侧重考查学生对知识的迁移应用,需要学生具备扎实的基础,难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
 据报道,某些花岗岩会产生放射性的氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害.请回答:
据报道,某些花岗岩会产生放射性的氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
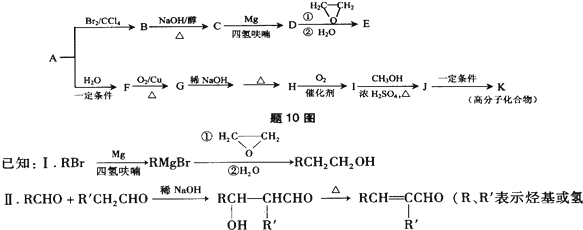
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
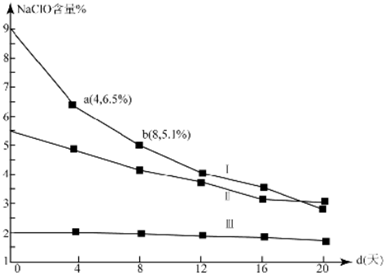
| 反应Ⅰ | Cl2+H2O?Cl-+H++HClO K1=4.5×10-4 |
| 反应Ⅱ | Cl2+2OH-?Cl-+ClO-+H2O K2=7.5×1015 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙炔 | B. | 乙烯 | C. | 乙炔 | D. | 丁烯? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A(A-N+m)mol}$ | B. | $\frac{a}{A}$(A-N) mol | C. | $\frac{a}{A+m}$(A-N) mol | D. | $\frac{a}{A+m}$(A-N+m) mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com