
考查的知识点:元素周期律如氢化物酸性强弱比较、单质氧化性强弱比较;原子结构;元素化合物知识
解析:注意题干中关键词“原子序数依次递增”、“短周期”等
X: X是自然界中构成化合物种类最多的元素,所以X可能是H或C,但X具有多种同素异形体,所以X是C,C形成的常见同素异形体有金刚石、石墨、C60等
Y: 同周期元素的化合价周期性变化规律: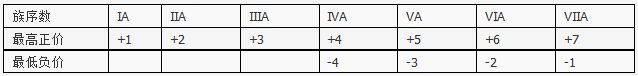
Y的最高正价是最低负价绝对值的3倍,所以Y处于VIA,又由于Y为短周期元素且有最高正价,所以Y为S,因为O无最高正价
Z: Y和Z为同周期,Z也属于短周期元素且原子序数比Y大,所以Z为Cl
R: R和Z同主族且原子序数大于Z,所以R可能是Br或I
选项A:当R为Br时,8035R的中子数位45,当R为I时,中子数将比45更小,所以A错
选项B:Y、Z、R对应的氢化物依次为H2S、HCl、HBr或HI,氢硫酸为弱酸,HCl、HBr或HI都为强酸且酸性依次增强,由于H—Cl、H—Br、H—I的键长依次增大,键能依次减小,在水分子作用下更容易电离出H+ ,使得酸性增强。所以B正确
选项C:X、Y、R、Z形成的单质依次为C、S、Br2或I2、Cl2。因为非金属性C<S,所以单质氧化性C<S ;由非金属活动性顺序表可知,非金属性F>Cl>Br>I>S,氧化性F2>Cl2>Br2>I2>S ,所以C正确
选项D:C与浓硫酸共热会生出CO2、SO2和H2O,所以D正确


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A.原子序数:a<b<c<d??
B.原子半径:X>Y>Z>R?
C.离子半径:X>Y>Z>R?
D.原子序数:b<a<d<c??
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可化合生成气体G,其水溶液pH>7;Y的单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z分别与钠元素可形成化合物Q和J, J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀I;Z与氢元素形成的化合物与G反应生成M。
请回答下列问题:
(1)M固体的晶体类型是 。
(2)Y基态原子的核外电子排布式是 ① ;G分子中X原子的杂化轨道类型是 ② 。
(3)L的悬浊液中加入Q的溶液,白色沉淀转化为黑色沉淀,其原因是 。
(4)R的一种含氧酸根RO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(四川卷带解析) 题型:填空题
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
请回答下列问题:
(1)M固体的晶体类型是 。
(2)Y基态原子的核外电子排布式是 ① ;G分子中X原子的杂化轨道的类型是 ② 。
(3)L的悬浊液加入Q的溶液,白色沉淀转化为黑色沉淀,其原因是 。
(4)R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(四川卷解析版) 题型:填空题
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
请回答下列问题:
(1)M固体的晶体类型是 。
(2)Y基态原子的核外电子排布式是 ① ;G分子中X原子的杂化轨道的类型是 ② 。
(3)L的悬浊液加入Q的溶液,白色沉淀转化为黑色沉淀,其原因是 。
(4)R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com