

分析 (1)根据生成1mol水蒸气放热569.1kJ计算生成9 mol水蒸气放出的热量,然后书写热化学反应方程式;
(2)据图分析放电时的总反应方程式,放电过程为原电池,根据乙中的电极反应来分析pH.
解答 解:(1)汽油燃烧的方程式为C8H18+25/2O2=8CO2+9H2O,生成1mol水蒸气放热569.1 kJ,故生成9 mol水蒸气放热569.1 kJ×9=5121.9 kJ,
其热化学方程式为C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(g)△H=-5121.9 kJ•mol-1,
故答案为:C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g)△H=-5121.9 kJ•mol-1;
(2)混合动力车上坡或加速时,电动机提供推动力,是电池放电,由图转化关系可知,NiOOH转变为Ni(OH)2,总反应方程式为H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,乙电极周围因氢氧根离子的浓度增大,故pH将增大,
故答案为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2;增大;NiOOH+H2O+e-=Ni(OH)2+OH-.
点评 本题考查了热化学方程式书写、原电池与电解池的工作原理等重点知识,关键问题在于知识的理解和运用.并注意化学反应原理是高考中的重要考点,核心知识为热化学方程式、原电池与电解池的工作原理等问题,复习过程中要加强重视程度,以理解方法、原理为主.


科目:高中化学 来源: 题型:选择题
| A. | 每一周期元素都是从碱金属开始,以稀有气体结束 | |
| B. | f区都是副族元素,s区和p区的都是主族元素 | |
| C. | 铝的第一电离能大于钾的第一电离能 | |
| D. | 同周期元素从左到右电负性逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 将1.0 mol氮气、3.0 mol氢气,置于1 L密闭容器中发生反应,放出的热量为 92.4 kJ | |
| B. | 平衡状态由A变到B时,平衡常数K (A)<K (B) | |
| C. | 上述反应在达到平衡后,增大压强,H2的转化率提高 | |
| D. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀H2SO4,过滤 | B. | 加入NaCl溶液,过滤 | ||
| C. | 加入NaOH溶液,过滤 | D. | 加入CuSO4溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 标况下1 L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA/22.4 | |
| C. | 1 mol甲基含7 NA个电子 | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
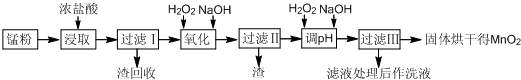
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com