
0.1摩尔某元素的单质一定条件下跟过量的氯气充分反应后,生成物的质量比该单质增加7.1克。则这种元素不可能是下列元素中的
A.H B.Cu C.Mg D.Fe
科目:高中化学 来源: 题型:
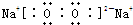
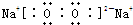
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
(1)四种元素的符号分别为:A________,B________,C________,D________。
(2)B、C两元素最高价氧化物水化物的化学式分别是________,________。
(3)在盛有B的氢氧化物的试管中,分别加入强酸和强碱时,其现象分别是________,________,离子方程式分别是________,________。
(4)A和D形成化合物的电子式是________,化合物中化学键类型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:022
已知A、B、C、D四种元素,A和B的离子结构都和氖原子具有相同的电子排布。C的离子结构比氖原子多8个电子,D的离子结构比氙原子少18个电子,A元素位于某一周期的开始,其离子的焰色为黄色;B元素的单质每摩尔能从酸中置换出1.5mol氢气,C元素离子的焰色为紫色;D元素的单质在常温下为液态,它的负一价离子能跟银离子反应生成不溶于硝酸的沉淀,
(1)四种元素的符号分别为:A________,B________,C________,D________。
(2)B、C两元素最高价氧化物水化物的化学式分别是________,________。
(3)在盛有B的氢氧化物的试管中,分别加入强酸和强碱时,其现象分别是________,________,离子方程式分别是________,________。
(4)A和D形成化合物的电子式是________,化合物中化学键类型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一种同位素R具有微弱放射性,其原子核内中子数比质子数多43,由它组成的固体单质A,在一定条件下密度为6.88 g/m3,用X射线研究其固体表明,在边长为1.00×10-7 cm的立方体中含有20个原子。
R在化学反应中常表现为+2、+4价,在溶液中R2+稳定,而R4+有强氧化性,可将NO氧化为HNO3。回答:
(1)R的摩尔质量为__________。
(2)R处于周期表第__________周期__________族。
(3)将含R4+的溶液加入到Fe(NO3)2溶液中,反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省唐山市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题。
(1)该配位化合物X的化学式为????????????? 。
(2)元素B、C、D的第一电离能的由小到大排列顺序为????????? 。(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为________??????????????????????????? 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为??????????????????????????????? 。
(5)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如下图:其中碳原子的杂化方式有____???????????????????? 。碳铂中含有的作用力有?????????????????? (填字母)。

A.共价键
B.配位键
C.金属键
D. 键
键
E. 键
键
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式??????????????????????? 。单质E的晶胞如图所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为p=??????? g/cm3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com