
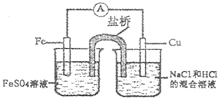
 根据下图判断,下列正确的说法是( )
根据下图判断,下列正确的说法是( )

 口算能手系列答案
口算能手系列答案科目:高中化学 来源:2012-2013学年吉林省实验中学高二上学期期末考试化学试卷(带解析) 题型:填空题
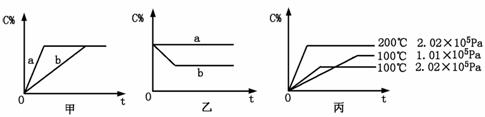
(6分)如下图,甲、乙、丙分别表示在不同条件下可逆反应:
A(g)+B(g) xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。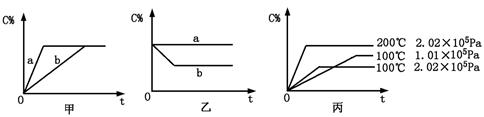
请根据图象回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则 曲线表示无催化剂时的情况(填字母,下同);
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性气体后的情况,则 曲线表示恒温恒容的情况;
(3)根据丙图可以判断该可逆反应的正反应是 热反应(填“吸”或“放”),计量数x的值 (填取值范围);判断的依据分别是 。
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高二上学期期末考试化学试卷(解析版) 题型:填空题
(6分)如下图,甲、乙、丙分别表示在不同条件下可逆反应:
A(g)+B(g) xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
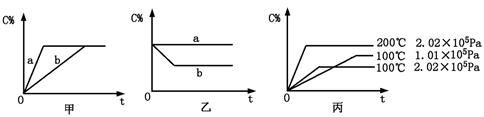
请根据图象回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则 曲线表示无催化剂时的情况(填字母,下同);
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性气体后的情况,则 曲线表示恒温恒容的情况;
(3)根据丙图可以判断该可逆反应的正反应是 热反应(填“吸”或“放”),计量数x的值 (填取值范围);判断的依据分别是 。
查看答案和解析>>
科目:高中化学 来源:0115 会考题 题型:填空题
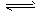 xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图: 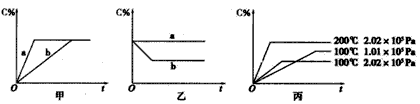
查看答案和解析>>
科目:高中化学 来源:0114 月考题 题型:填空题
 CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题: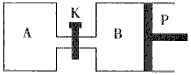
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图,甲、乙、丙分别表示在不同条件下可逆反应:
A(g)+B(g)![]() xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
请根据图象回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则 曲线表示无催化剂时的情况(填字母,下同);
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性气体后的情况,则 曲线表示恒温恒容的情况;
(3)根据丙图可以判断该可逆反应的正反应是 热反应(填“吸”或“放”),计量数x的值 (填取值范围);判断的依据分别是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com