
日常生活中使用的铝合金中的铝来自于电解氧化铝.工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等.工业生产铝锭的工艺流程示意图如下: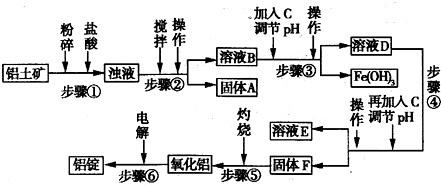
一些氢氧化物沉淀的pH如表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度为0.01mol/L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子初始浓度为<10-5mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)实验室进行步骤④的操作名称为______.
(2)固体A的化学式为______,物质C的化学式为______.
(3)步骤④调节pH的范围为______.
(4)步骤⑥反应的化学方程式为______.
 4Al+3O2↑,
4Al+3O2↑, 4Al+3O2↑.
4Al+3O2↑.

科目:高中化学 来源: 题型:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度为0.01mol/L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子初始浓度为<10-5mol/L) | 5.2 | 4.1 | 12.4 |
| ||
| 冰晶石 |
| ||
| 冰晶石 |
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铝广泛应用于现代生产和日常生活中。
已知:4Al(s)+3O2(g)=2Al2O3(s) △H=-3351.4 kJ?mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1633.2 kJ?mol-1
![]() △H=-5518 kJ?mol-1
△H=-5518 kJ?mol-1
将铝用作燃料已成为现实。回答下列问题:
(1)写出工业制铝的阳极电极反应式 。
(2)①铝用作燃料相对于含碳燃料有明显优点,请你写出其中一条 ;
②铝用作燃料相对于氢气也有明显优点,但也有不足,即燃点高。若要在常温常压不使用催化剂的情况下点燃铝,除了应防止表面生成致密的氧化膜外,还应采取的措施是 。
(3)铝热反应在生产中的应用非常广泛。请写出Fe2O3(s)和Al(s)反应的热化学方程式 ;
铝热实验中能看到有熔融物生成,为探究该熔融物的成分,某学生查阅资料如下:
| 物质 | A1 | A12O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | ― |
经分析,该同学推测,铝热反应所得到的熔融物应是铁铝合金。请设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝(简述实验操作、现象及结论) 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
A.(15分) 化学与我们日常生活中的吃、穿、住、行、医关系密切
(1)油脂、淀粉、蛋白质是我们食物中提供能量的主要物质。它们在人体内都能发生水解。
①油脂水解的最终产物是 ▲ 和 ▲ 。
②淀粉水解的最终产物是 ▲ 若要检验淀粉的淀粉酶作用下已经发生了水解,可取少量上述溶液加入 ▲ (填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解的,可取少量上述溶液加入几滴 ▲ 溶液,应观察到出现蓝色。
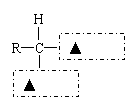 ③蛋白质在人体内水解的最终产物是氨基酸。请在下图虚线方框内写上适当的官能团符号,将氨基酸的通式补充完整:
③蛋白质在人体内水解的最终产物是氨基酸。请在下图虚线方框内写上适当的官能团符号,将氨基酸的通式补充完整:
(2)现在越来越多的自行车采用铝合金作材料,它不仅轻便美观,而且也很耐久。它能长期使用的原因是 ▲ 。
(3)聚丙烯腈——合成腈纶又称人造羊毛,如何用简单的方法区别一件羊毛衫是否为真品 ▲ ,丙烯腈为CH2=CHCN 请写出聚丙烯腈的结构 ▲
(4)钙塑板是一种质轻、消声、隔热、防潮的新型家居装修材料。它是以高压聚乙烯、轻质碳酸钙和少量助剂为原料制成的。下列有关钙塑板的说法不正确的是 ▲
A.钙塑板是一种复合材料
B.钙塑板可作隔音材料
C.钙塑板可以长期接触酸性溶液而不被腐蚀
D.钙塑板在制造过程中掺入的碳酸钙应该适量
(5)氢氧化铝、碳酸镁、碳酸氢钠都可用于治疗胃酸过多引起的不适。请分别写出相关反应的离子方程式:
① ▲ ② ▲
③ ▲
④碳酸氢钠还是常用的疏松剂,在加热的条件下产生气体,使食品变得疏松。请写出反应方程式 ▲
查看答案和解析>>
科目:高中化学 来源:2011年重庆市万州区高考化学一模试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com