
化学平衡常数(K)是化学反应限度的一个重要参数,该常数表示的意义是可逆反应进行的程度,K值越大,表示的意义错误的是( )
| A.温度越高 | B.反应物浓度越小 |
| C.反应进行的越完全 | D.生成物浓度越大 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
反应A(g)+3B(g) 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)=0.4 mol / (L·s) B.υ(C)=0.5 mol / (L·s)
C.υ(B)=0.6 mol / (L·s) D.υ(A)=0.15 mol / (L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在2 L密闭容器中发生反应4A(s)+3B(g)=2C(g)+D(g),经2 min,B的物质的量减少0.6 mol,下列对该反应速率表示正确的是
A.在2 min末的反应速率:v (B)=0.3 mol·L-1·min-1
B.用A表示的反应速率为:v (A)=0.4 mol·L-1·min-1
C.用D表示的平均反应速率为:v (D)= 0.05 mol·L-1·min-1
D.分别用B、C表示的反应速率其比值为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
 2Z,其平衡常数值为1600
2Z,其平衡常数值为1600查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应A(g)+3B(g) 2C(g) ΔH=-QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2。下列叙述不正确的是
2C(g) ΔH=-QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2。下列叙述不正确的是
A.甲中A的转化率为75% B.Q1+Q2=Q
C.达到平衡后,再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向正向移动
D.乙中的热化学方程式为2C(g) A(g)+3B(g) ΔH=+Q2 kJ/mol
A(g)+3B(g) ΔH=+Q2 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应A(s)+B? ?C达到平衡后,B的转化率与压强、温度的关系如图所示。下列说法正确的是( )
?C达到平衡后,B的转化率与压强、温度的关系如图所示。下列说法正确的是( )
A.B是固体,C是固体,正反应是吸热反应
B.B是气体,C是固体或液体,正反应是吸热反应
C.B是气体,C是固体或液体,正反应是放热反应
D.B、C都是气体,正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示曲线表示其它条件一定时反应2NO(g)+O2(g) 2NO2(g) △H<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达平衡状态且V(正)>V(逆)的点是
2NO2(g) △H<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达平衡状态且V(正)>V(逆)的点是
| A.a点 | B.b点 | C.c 点 | D.d点 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)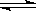 3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
| A.X的转化率为:甲<丙<乙<丁 | B.X的转化率为:甲<乙<丙<丁 |
| C.Y的转化率为:甲>丙>乙>丁 | D.Y的转化率为:丁>乙>丙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,一定能够加快反应速率,又不影响产生H2总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥无水乙酸
| A.①③④ | B.②④⑥ | C.②⑤⑥ | D.①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com