
 双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题:
双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题: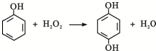 .
. 分析 (1)根据结构式的定义来解答,一对共用电子对用一个短线来表示;
(2)双氧水有强氧化性;
(3)根据化合价升高总数和降低总数相等;
(4)氧气、水得电子生成HO2-;
(5)根据反应方程式和反应的H2O2确定消耗的HCHO,然后确定转化率;
(6)Y中苯环上的氢原子被氯原子取代后只有一种一氯代物,说明苯环上只有一种氢原子;
解答 解:(1)一对共用电子对用一个短线来表示,所以结构式为:H-O-O-H,故答案为:H-O-O-H;
(2)双氧水有强氧化性,能杀菌消毒,故答案为:B;
(3)根据化合价升高总数和降低总数相等可知离子方程式:2ClO3-+2H++H2O2=O2↑+2ClO2+2H2O,故答案为:2;2;1;1;2;2;
(4)氧气、水在正极得电子生成HO2-,电极反应式是O2+H2O+2e-=HO2-+OH-,故答案为:a;O2+H2O+2e-=HO2-+OH-;
(5)反应的H2O2的浓度为0.15mol/L-0.06mol/L=0.09mol/L,根据HCHO+2H2O2=CO2+2H2O可知,反应的甲醛为0.045mol/L,HCHO的转化率为$\frac{0.045mol/L}{0.05mol/L}$=90%,故答案为:90%;
(6)Y中苯环上的氢原子被氯原子取代后只有一种一氯代物,说明苯环上只有一种氢原子,化学方程式是: ,故答案为:
,故答案为: .
.
点评 本题考查有机物的结构与性质、化学方程式的计算等,把握氧化还原反应的配平方法为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4 | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C26H54 | B. | C17H36 | C. | C80H162 | D. | C106H214 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
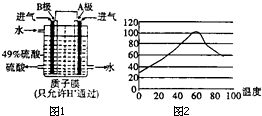 我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品.
我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品. ①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲是乙烯 | B. | 乙可能是葡萄糖 | ||
| C. | 丙与NaOH溶液反应不能生成乙醇 | D. | 丁十H2→乙醇的反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SiO3溶液中滴加适量稀HCl制硅酸胶体:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 用稀HNO3清洗试管壁上的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| C. | (NH4)2SO4溶液与过量Ba(OH)2溶液混合:NH4++SO42-+Ba2++OH-═BaSO4↓+NH3•H2O | |
| D. | SO2通入氯水中:Cl2+SO2+2H2O═SO42-+2Cl-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,增大压强,平衡不发生移动 | |
| B. | 其他条件不变,增大压强,混合气体的总质量不变 | |
| C. | 该反应式中n值一定为2 | |
| D. | 原混合气体中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com