
(12分)化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置。完成下列问题:
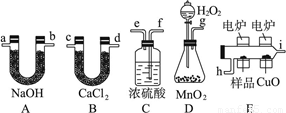
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是________________。
(2)C装置中浓硫酸的作用是____________。(3)D装置中MnO2的作用是__________________。
(4)燃烧管中CuO的作用是__________________。
(5)若准确称取0.9 g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物的实验式为__________________________。
(6)若该有机物溶于水,其分子式中氢原子为4,则其结构简式为______________。
(1)g、f、e、h、i、c(或d)、d(或c)、a(或b)、b(或a)(也可考虑在末端再加ab,吸收空气中的水与二氧化碳)
(2)吸收水分,得干燥纯净的氧气 (3)催化剂,加快产生氧气的速率
(4)使有机物更充分地被氧化,生成二氧化碳和水 (5)CH2O (6) CH3COOH
【解析】
试题分析:(1)首先对产生的氧气通过浓硫酸进行干燥,再将样品氧化,利用B、A吸收样品产生的水和二氧化碳。故各导管的连接顺序g、f、e、h、i、c(或d)、d(或c)、a(或b)、b(或a)。
(2)C装置中浓硫酸的作用是干燥氧气。
(3)D装置中MnO2的作用是做过氧化氢分解的催化剂,加快产生氧气的速率。
(4)防止一氧化碳的生成,再氧不充足时会生成一氧化碳,而氧化铜和一氧化碳反应生成二氧化碳,所以燃烧管中CuO的作用是使有机物更充分地被氧化,生成二氧化碳和水。
(5)A管质量增加1.32 g,为二氧化碳的质量,
m(C)=1.32g¸44g/mol´12g/mol=0.36g
B管质量增加0.54 g,为水的质量。
m(H)=0.54g¸18g/mol´2´1g/mol=0.06g
m(O)=0.9-0.36-0.06=0.48g
C、H、O原子个数比为:1:2:1,即实验式:CH2O
(6)该有机物溶于水,其分子式中氢原子为4,分子式为C2H4O2,为乙酸CH3COOH。
考点:有机物分子式的确定
点评:本题考查了有机分子式的确定实验原理和相关计算。综合性较强。要求学生对有机分子式的确定方法比较熟悉。


科目:高中化学 来源: 题型:
( 12分)从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限。
(1)上述图中的三种常用金属的开发利用之所以有先后,主要取决于
A、金属的导电性强弱 B、金属在地壳中的含量多少
C、金属的化合价高低 D、金属的活动性大小
(2)早在西汉成书的《淮南万毕术》里,就有"曾青得铁则化为铜"的记载。曾青又有空青、 白青、石胆、胆矶等名称其实都是天然的硫酸铜。
①写出"曾青得铁则化为铜"的离子方程式 。
②若根据上述反应设计成原电池,则:该原电池的电解质溶液为:
正极材料为: 正极上发生的反应为:
(3)铁路工人常用铝热反应来焊接钢轨,写出有关的化学方程式:
。 教材中引发铝热反应的试剂是 和
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省邢台一中高二第三次月考化学试卷(带解析) 题型:实验题
(12分)化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置。完成下列问题: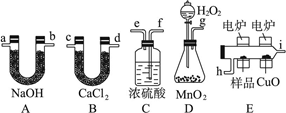
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是________________。
(2)C装置中浓硫酸的作用是____________。(3)D装置中MnO2的作用是__________________。
(4)燃烧管中CuO的作用是__________________。
(5)若准确称取0.9 g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物的实验式为__________________________。
(6)若该有机物溶于水,其分子式中氢原子为4,则其结构简式为______________。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省苏南四校高三12月月考试化学试卷(带解析) 题型:填空题
(12分)双氧水、过硫酸钾是工业上常用的氧化剂、消毒剂。工业上以铂为阳极,铅或石墨为阴极,电解NH4HSO4溶液得过硫酸铵【(NH4)2S2O8】溶液,其工艺流程为:
(1)将电解后的溶液送往水解器中在减压条件下水解、蒸馏、浓缩分离,精馏得过氧化氢的水溶液,剩余溶液再循环使用。
①写出电解NH4HSO4溶液的化学方程式
②写出水解器中(NH4)2S2O8溶液的水解方程式 。
③铂价格昂贵,试分析电槽阳极用铂不用铅的原因 。
④试分析水解器中使用减压水解、蒸馏的原因 。
(2)在电解后的过硫酸铵溶液中加入硫酸氢钾,析出过硫酸钾固体,过硫酸钾具有强氧化性,常被还原为硫酸钾,80℃以上易发生分解。
①将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如右图所示(H+浓度未画出)。图中物质X的化学式为 。
②已知硫酸锰(MnSO4)和过硫酸钾(K2S2O7)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。此反应的离子反应方程式 .
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省常州市高三上学期期中考试化学 题型:填空题
(12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
|
湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
|
干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
①反应I的化学方程式为 ▲ 。
②反应II的离子方程式为 ▲ 。
③加入饱和KOH溶液的目的是 ▲ 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ▲ ,____▲______。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 ▲ 。
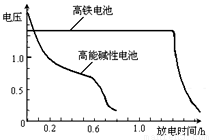
(4)高铁电池是正在研制中的可充电干电池,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com