
| A. | 任何晶体中,若含有阳离子就一定有阴离子 | |
| B. | 原子晶体中只含有共价键 | |
| C. | 原子晶体的熔点一定比金属晶体的高 | |
| D. | 分子晶体中只含有范德华力 |
分析 A、金属晶体中有阳离子,但没有阴离子;
B、原子晶体是原子间通过共价键结合成的空间网状结构的晶体;
C、原子晶体的熔点不一定比金属晶体的高;
D、分子晶体分子间存在范德华力,而分子内可能存在共价键.
解答 解:A、金属晶体是由金属阳离子和自由电子形成的晶体,晶体中有阳离子,但没有阴离子,故A错误;
B、原子晶体是原子间通过共价键结合成的空间网状结构的晶体,所以原子晶体中只含有共价键,故B正确;
C、原子晶体的熔点不一定比金属晶体的高,如金属晶体钨的熔点非常高,故C错误;
D、分子晶体分子间存在范德华力,而分子内可能存在共价键,所以分子晶体中不一定只含有范德华力,故D错误;
故选B.
点评 本题考查了晶体的构成微粒、晶体类型与物质熔点的关系,可根据物质的构成微粒判断晶体类型,但不能根据物质的熔点判断晶体类型,要注意的是:含阳离子的物质中不一定含阴离子,如金属晶体;但含阴离子的晶体一定含阳离子.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | |
| B. | 前后两次平衡后,容器内的压强不相等次是相等 | |
| C. | SO2、O2的转化率均增大 | |
| D. | 通18O2前、通18O2后、重新到平衡后三个时间段,v(正)与v(逆)的关系依次是相等、大于、相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
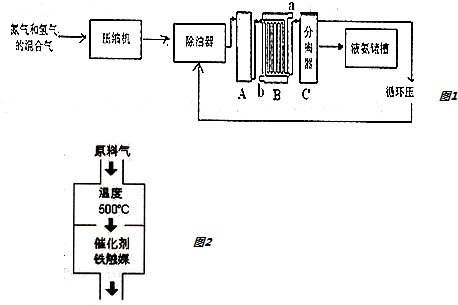
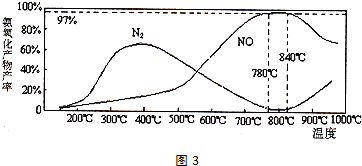
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 N,P,As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题:
N,P,As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题: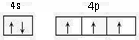 ,砷与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge.
,砷与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
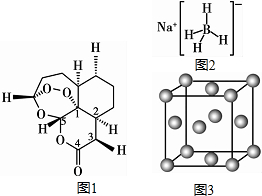 现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构
现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构查看答案和解析>>
科目:高中化学 来源: 题型:选择题
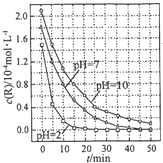
| A. | 在0-50min之间,pH=2 和 pH=7 时 R 的降解百分率相等 | |
| B. | 溶液酸性越强,R 的降解速率越小 | |
| C. | R的起始浓度越小,降解速率越大 | |
| D. | 在 20-25min之间,pH=10 时 R 的平均降解速率为 0.04mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | HX是弱酸,其c(OH-)是该盐酸中c(OH-)的104倍 | |
| B. | N点的pH>7的原因是由于NaOH过量所致 | |
| C. | M点c(HX)<c(X-) | |
| D. | P点c(Cl-)=0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
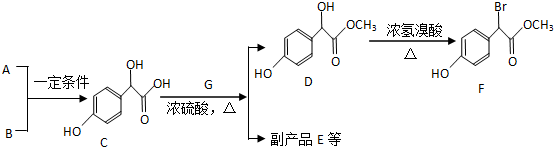
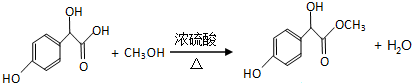
 .
.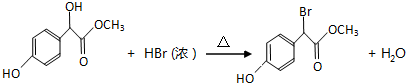
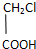
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com