
| A. | 分子式为C4H10的烷烃的二氯取代物 | |
| B. | 分子式为C4H10O2的有机物 | |
| C. | 乙苯的一氯取代物 | |
| D. | 和H2加成生成2-甲基戊烷的单烯烃 |
分析 A.丁烷有2种,然后分别写出二氯代物;
B、分子式为C4H10O2的有机物可以是二元醇还可以是醚类;
C、乙苯中乙基的一氯取代物是两种,苯环上的一氯取代物是3种;
D、与氢气加成生成2-甲基戊烷,则A分子中含有1个C=C双键,2-甲基戊烷的结构简式为(CH3)2CHCH2CH2CH3,还原碳碳双键确定可能结构.
解答 解:A.正丁烷有CH3CH2CH2CHCl2、CH3CH2CHClCH2Cl、CH3CHClCH2CH2Cl、CH2ClCH2CH2CH2Cl,CH3CCl2CH2CH3,CH3CHClCHClCH3.
异丁烷的一氯代物有2种:(CH3)2CHCH2Cl、(CH3)2CClCH3;
当一氯代物为(CH3)2CHCH2Cl时,二氯代物有3种:(CH3)2CHCHCl2、(CH3)2CClCH2Cl、CH3CH(CH2Cl)2;
当一氯代物为(CH3)2CClCH3时,二氯代物有1种:(CH3)2CClCH2Cl,与上面重复;
所以异丁烷的二氯代物的同分异构体共有3种,分子式为C4H10的烷烃的二氯取代物是8种,故A错误;
B、分子式为C4H10O2的有机物的同分异构体:HOCH2CH2CH2CH2OH、HOCH2CH2CH(OH)CH3、HOCH2CH(OH)CH2CH3、CH3CH(OH)CH(OH)CH3、HOCH2CH(CH3)CH2OH、(CH3)2C(OH)CH2OH,共六种,故B错误;
C、乙苯中乙基的一氯取代物是两种,苯环上的一氯取代物是3种,所以乙苯的一氯取代物是5种,故C错误;
D、与氢气加成生成2-甲基戊烷,则分子中含有1个C=C双键,2-甲基戊烷的结构简式为(CH3)2CHCH2CH2CH3,有机物的可能结构有:(CH3)2CHCH2CH=CH2、(CH3)2CHCH=CHCH3、(CH3)2C=CHCH2CH3、CH2=CH(CH3)CH2CH2CH3四种,故D正确.
故选D.
点评 本题考查同分异构体,题目难度不大,注意把握同分异构体概念的内涵与外延,需要注意的是同分异构体之间是不同的物质.


科目:高中化学 来源: 题型:选择题
| A. | 与少量乙二醛混合可制备乙二酸 | |
| B. | 与浓盐酸反应的离子方程式为:2MnO4-+16 H++10Cl-=5Cl2↑+2Mn2++8 H20 | |
| C. | 与K+、NO3-、SO42-、CO32-可以大量共存 | |
| D. | 与过量Na202混合后,共转移e-0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对PM2.5、SO2、NOx等进行研究,有助于了解雾霾和减弱雾霾的影响.请回答下列问题:
对PM2.5、SO2、NOx等进行研究,有助于了解雾霾和减弱雾霾的影响.请回答下列问题:| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol•L-1) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1( NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合所得酸性溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO-)+c(H+)>c(Na+)+c(OH-) | |
| D. | 向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| B. | 袋装食品常用生石灰作为食品的抗氧化剂 | |
| C. | 金属焊接时可用饱和NH4Cl溶液作除锈剂 | |
| D. | 泡沫灭火器的内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
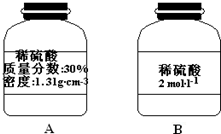
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
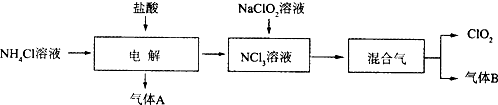
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在任何条件下,化学反应的焓变都等于化学反应的反应热 | |
| B. | △H>0时反应放热,△H<0时反应吸热 | |
| C. | △H越大,说明反应放出的热量越多 | |
| D. | 一个化学反应中,当反应物能量大于生成物能量时,反应放热,△H为“-” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com