
【题目】有如图所示装置,为实现下列实验目的,其中Y端适合于作入口的是 .
A.瓶内盛液体干燥剂,用以干燥气体
B.瓶内盛液体洗涤剂,用以除去某气体中的杂质
C.瓶内盛水,用以测量某难溶于水的气体的体积
D.瓶内贮存气体,加水时气体可被排出
E.收集密度比空气大的气体
F.收集密度比空气小的气体.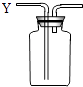
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】在指定条件下,下列各组离子一定不能大量共存的是
①能使红色石蕊试纸变蓝的溶液中:Na+ 、K+、CO![]() 、NO
、NO![]() 、[Al(OH)4]-
、[Al(OH)4]-
②c(H+)=0.1 mol·L-1的溶液中:Cu2+、Al3+、SO![]() 、NO
、NO![]()
③能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH![]() 、S2-、Br-
、S2-、Br-
④由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO![]()
⑤加入铝粉能产生氢气的溶液中:NH![]() 、Fe2+、SO
、Fe2+、SO![]() 、NO
、NO![]()
⑥含有大量Fe3+的溶液中:NH![]() 、Na+、Cl-、SCN-
、Na+、Cl-、SCN-
A. ①②③ B. ①③⑥
C. ③④⑤⑥ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1molAl2(SO4)3跟350mL2mol/LNaOH溶液混合,所得沉淀的质量为
A.78g B.15.6g C.7.8g D.3.9g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp(AgC1)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,下列说法正确的是
A. 向同浓度的Na2CrO4和NaC1混合溶液中滴加AgNO3溶液,AgCl先析出
B. 向AgCl饱和溶疲中加入NaCl晶体,有AgCl析出且溶液中cCl-)=c(Ag+)
C. AgCl和Ag2CrO4共存的悬浊液中, 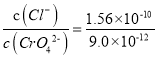
D. 向Ag2CrO4悬池液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了图1、图2两种实验装置. 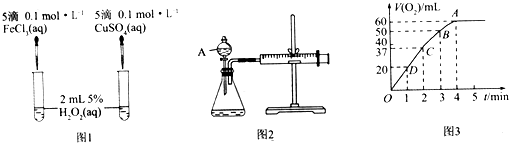
(1)若利用图1实验,可通过观察产生气泡的快慢定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 , 写出H2O2在二氧化锰催化作用下发生反应的化学方程式: . 若利用图2实验可进行定理分析,图中仪器A的名称为 , 实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是 .
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因: , H2O2初始物质的量浓度为(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:
在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5molL﹣1的硫酸,10s时收集到产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为molL﹣1s﹣1(假设反应前后溶液的体积不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.越王勾践剑(青铜)的铸造材料主要是铜锡合金
B.青花瓷制作原料的主要成分是硅酸盐
C.以毛竹为原料制作的竹纤维属于高分子材料
D.石墨烯是一种能导电的有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的说法中正确的是
A. 原子晶体中,共价键越强,熔点越高
B. 冰熔化时,水分子中共价键发生断裂
C. 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子晶体
D. 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(OH-)
)>c(OH-)
B. 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH![]() )+c(OH-)
)+c(OH-)
D. 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中: c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用如图所示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空: 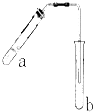
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序用操作是 .
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是 .
(3)实验中加热试管a的目的是:; .
(4)试管b中加有饱和Na2CO3溶液,其作用是 .
(5)反应结束后,振荡试管b,静置.反应结束后,试管B内的液体分成两层,乙酸乙酯在层(填写“上”或“下”).若分离10mL该液体混合物需要用到的主要玻璃仪器是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com