
| A、LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 | B、LiAlH4与D2O反应,所得氢气的摩尔质量为4 g?mol-1 | C、1 mol LiAlH4在125℃完全分解,转移3 mol电子 | D、LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O═Al(OH)3+LiOH+4H2↑ |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
 )、LiH是金属储氢材料,又是有机合成中的常用试剂,遇水均能剧烈反应释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )
)、LiH是金属储氢材料,又是有机合成中的常用试剂,遇水均能剧烈反应释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
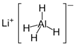 )、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )
)、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com