
(10分)
(1)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。
请在如图中标明电极材料和电解质溶液的名称

已知Ni的金属活动性介于Fe和Sn之间。则精炼完成后,在阳极底部的沉积物中可回收到的金属为 ________(填化学式)。
(2)若在实验室中完成此实验,可用铅蓄电池做电源。铅蓄电池的电池总反应式为:
2PbSO4+2H2O  Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42-
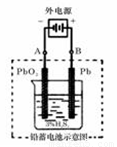
在完全放电耗尽PbO2和Pb时,若按上图所示连接进行充电,充电一段时间后,则在A电极上生成__________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(3)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重0.16 g 。请回答下列问题:

①B电极的反应式_____________________。
②原溶液的物质的量浓度是_________________;电解后溶液的pH为 ________。(假设电解前后溶液的体积不变)
(1)左 精铜 右 粗铜 硫酸铜溶液 Ag、Au
(2)Pb PbO2 B
(3)①4OH――4e-=2H2O+O2↑ ②0.005mol/L 2
【解析】考查电化学原理的应用
(1)粗铜精炼时,粗铜和电源的正价相连,作阳极。纯铜和电源的负极相连,作阴极,电解质溶液是硫酸铜溶液。纯铜中含有的杂质铁和镍的活泼性均强于铜的,所以二者首先失去电子。银和金的活泼性弱于铜的,在铜存在的条件下,二者不可能失去电子,二者最终形成阳极泥。
(2)根据装置图可判断A和电源的负极相连,作阴极,得到电子发生还原反应,电极反应式
为PbSO4+2e-=Pb+SO42-。B和电源的正极相连,作阳极,失去电子发生氧化反应,电极反应式为PbSO4-2e-+ 2H2O = PbO2 + 4H+ +SO42-。所以A极生成铅,B极生成二氧化铅,因此蓄电池的正负极的极性将对换,即B将是正极。
(3)根据溶液显蓝色,以及析出红色的固态物质可判断,该固态物质一定是铜,铜;离子在阴极达到电子,析出铜单质,电极反应式为Cu2++2e-=Cu。则B极是阳极,且生成的气体是无色的,所以是溶液中OH―放电,失去电子,发生氧化反应生成氧气,电极反应式为4OH――4e-=2H2O+O2↑。电极增重0.16 g,即铜是0.16g,物质的量为 ,所以原溶液的浓度为
,所以原溶液的浓度为 。每消耗1mol铜离子,则同时生成2mol氢离子,所以氢离子的浓度为0.005mol/L×2=0.11mol/L,因此pH=2。
。每消耗1mol铜离子,则同时生成2mol氢离子,所以氢离子的浓度为0.005mol/L×2=0.11mol/L,因此pH=2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(10分)
(1)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。
请在如图中标明电极材料和电解质溶液的名称
已知Ni的金属活动性介于Fe和Sn之间。则精炼完成后,在阳极底部的沉积物中可回收到的金属为 ________(填化学式)。
(2)若在实验室中完成此实验,可用铅蓄电池做电源。铅蓄电池的电池总反应式为:
2PbSO4+2H2O Pb+PbO2+4H++2SO42-
在完全放电耗尽PbO2和Pb时,若按上图所示连接进行充电,充电一段时间后,则在A电极上生成__________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(3)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重0.16 g 。请回答下列问题:
①B电极的反应式_____________________。
②原溶液的物质的量浓度是_________________;电解后溶液的pH为 ________。(假设电解前后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源:2010年山东省潍坊市高三上学期开学摸底考试化学试题 题型:填空题
(10分)
(1)甲烷是一重要的清洁能源、请写出以KOH溶液为电解质溶液,甲烷燃料电池的正极反应式: 。
(2)电解原理在化学工业中有广泛的应用。图中a为电解液,X和Y是两块电极板,则:
①若X和Y分别为铁和石墨,a为饱和食盐水,则电解时X电极反应式为 。
②若X、Y分别为石墨和铁,a为饱和食盐水,则电解过程中生成的白色固体露置在空气中,可观察到的现象是 。
(3)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。电解完毕后,某兴趣小组欲对电解溶中的离子进行分离,他们通过查阅资料,得知相关氢氧化物在不同pH下的溶解度曲线如下图。
①结合右图分析,相同温度下Kap[Cu(OH)2]、Kap[Ni(OH)2]、Kap[Fe(OH)2]由大到小的顺序为 。
②分离过程中,使上述溶液的pH逐渐增加,则溶液中的Cu2+、Fe2+和Ni2+沉淀的先后顺序依次为 (填写离子符号)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建师大附中高二下学期期中考试化学试卷(带解析) 题型:填空题
(10分)
(1)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。
请在如图中标明电极材料和电解质溶液的名称
已知Ni的金属活动性介于Fe和Sn之间。则精炼完成后,在阳极底部的沉积物中可回收到的金属为 ________(填化学式)。
(2)若在实验室中完成此实验,可用铅蓄电池做电源。铅蓄电池的电池总反应式为:
2PbSO4+2H2O  Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42-
在完全放电耗尽PbO2和Pb时,若按上图所示连接进行充电,充电一段时间后,则在A电极上生成__________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(3)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重0.16 g。请回答下列问题:
①B电极的反应式_____________________。
②原溶液的物质的量浓度是_________________;电解后溶液的pH为 ________。(假设电解前后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com