

分析 向MgCl2溶液中加入NaClO溶液,然后向溶液中加入NaOH溶液并调节溶液的pH,碱式次氯酸镁[Mg2ClO(OH)3•H2O]微溶于水,所以得到碱式次氯酸镁[Mg2ClO(OH)3•H2O]沉淀和NaCl,过滤得到碱式次氯酸镁[Mg2ClO(OH)3•H2O]固体,滤液中成分是NaCl,然后将沉淀洗涤、干燥得到碱式次氯酸镁[Mg2ClO(OH)3•H2O],可据此分析作答:
(1)滤液中的主要物质是NaCl;
(2)Cl2与NaOH溶液反应生成NaCl、NaClO和H2O;
(3)MgCl2和NaClO溶液中加入NaOH溶液并调节溶液的pH=10,可得到碱式次氯酸镁[Mg2ClO(OH)3•H2O],结合质量守恒定律可写出此反应的化学方程式;
(4)制备碱性次氯酸镁的反应中没有元素化合价的变化.
解答 解:向MgCl2溶液中加入NaClO溶液,然后向溶液中加入NaOH溶液并调节溶液的pH,碱式次氯酸镁[Mg2ClO(OH)3•H2O]微溶于水,所以得到碱式次氯酸镁[Mg2ClO(OH)3•H2O]沉淀和NaCl,过滤得到碱式次氯酸镁[Mg2ClO(OH)3•H2O]固体,滤液中成分是NaCl,然后将沉淀洗涤、干燥得到碱式次氯酸镁[Mg2ClO(OH)3•H2O],
(1)滤液中的主要物质是NaCl,所以滤液中可回收的主要物质是NaCl,故答案为:NaCl;
(2)Cl2与NaOH溶液反应生成NaCl、NaClO和H2O,反应方程式为2NaOH+Cl2=NaCl+NaClO+H2O,故答案为:2NaOH+Cl2=NaCl+NaClO+H2O;
(3)MgCl2和NaClO混合溶液中加入NaOH得到碱式次氯酸镁,发生反应的化学方程式为2MgCl2+NaClO+3NaOH+H2O═Mg2ClO(OH)3•H2O+4NaCl,故答案为:2MgCl2+NaClO+3NaOH+H2O═Mg2ClO(OH)3•H2O+4NaCl;
(4)(3)中反应前后无元素化合价的变化,属非氧化还原反应,故答案为:非氧化还原反应;无元素化合升降.
点评 本题考查物质分离和提纯,侧重考查学生分析、计算、信息利用能力,明确工艺流程原理是解本题关键,知道每一步发生的反应及其操作,熟练掌握元素化合物知识是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CuCl2+H2S═CuS↓+2HCl | B. | 2HCl+Na2S═2NaCl+H2S | ||
| C. | Cl2+H2S═2HCl+S | D. | 3Cl2+6FeSO4═2Fe2(SO4)3+2FeCl3 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
下列有关氮元索及其化合物的表示正确的是
A. 质子数为7、中子数为7的氮原子:147N
B. 氮原子的结构示意图:
C. 氨气分子的电子式:
D. 对硝基甲苯的结构简式: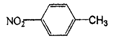
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

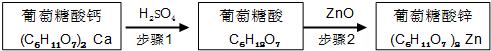
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取少量溴乙烷的装置如下图所示,根据题意完成下列填空:
实验室制取少量溴乙烷的装置如下图所示,根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
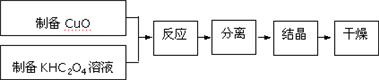
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (乙酸酐)制备过程中还有CH3COOH+AlCl3→CH3COOAlCl2+HCl↑等副反应.
(乙酸酐)制备过程中还有CH3COOH+AlCl3→CH3COOAlCl2+HCl↑等副反应.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com