
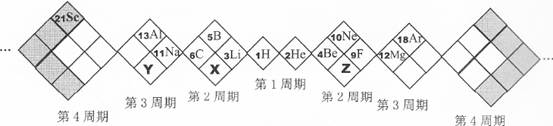
| A.X、Y、Z元素分别为N、P、O |
| B.白格中都是主族元素,灰格中都是副族元素 |
| C.原子半径:Z>X>Y |
| D.X、Y、Z的气态氢化物中最稳定的是:Z的氢化物 |
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解饱和食盐水时,溶液中的OH-向阴极移动 |
| B.需要加热才能发生的反应不一定是吸热反应 |
| C.短周期元素形成离子后,最外层都能达到8(或2)电子稳定结构 |
| D.金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | | | | E | | F | | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | H | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元 素 | 性 质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.原子半径:Z>W>R>E |
| B.R的气态氢化物比X的气态氢化物沸点高 |
| C.Z与Y可形成既含离子键又含共价键的化合物 |
| D.Z的最高价氧化物对应水化物与W的最高价氧化物对应水化物能发生反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A. O和 O和 O中子数相同,质子数不同,互为同位素 O中子数相同,质子数不同,互为同位素 |
| B.H2O比H2S稳定,H-S键比H-O键更难断裂 |
| C.Na2O晶体中存在离子键,是离子化合物 |
| D.Na2O2晶体中阳离子与阴离子个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 价。
价。 O2 +[O]-Q 平衡常数为K1 ;
O2 +[O]-Q 平衡常数为K1 ;  2O2+Q 平衡常数为K2 ;
2O2+Q 平衡常数为K2 ; 3O2+Q 平衡常数为K。
3O2+Q 平衡常数为K。| pH t / min T / ℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com