


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 灼烧 |
| 浸泡 |
| 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修化学与技术](15分)
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)2NH3(g),其
部分工业流程如下:
回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+O2(g)=2H2(g) △H=-483.6kJ/mol
则N2(g)+2H22NH3(g)的△H= ;
(2)如果工业上,在一定温度下,将1.5molN2气体和6molH2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为 。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是 ;
①增大压强 ②增大反应物质的浓度
③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数很小,所以在工业采取气体循环的流程。即反应后通过降低混合气体的温度而使氢气分离出来。这种分离物质的方法其原理类似于下列哪种方
法? (填编号)
①过滤 ②蒸馏 ③渗析 ④萃取
理由是 ;
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为 ;
(5)假如该厂生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水 mL(用100mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH 14-a(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江省四校联考一模(理综)化学部分 题型:填空题
[化学——选修化学与技术](15分)
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),其
2NH3(g),其
部分工业流程如下: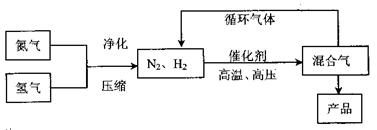
回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+O2(g)=2H2(g) △H=-483.6kJ/mol
则N2(g)+2H2 2NH3(g)的△H= ;
2NH3(g)的△H= ;
(2)如果工业上,在一定温度下,将1.5molN2气体和6molH2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为 。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是 ;
①增大压强 ②增大反应物质的浓度
③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数很小,所以在工业采取气体循环的流程。即反应后通过降低混合气体的温度而使氢气分离出来。这种分离物质的方法其原理类似于下列哪种方
法? (填编号)
①过滤 ②蒸馏 ③渗析 ④萃取
理由是 ;
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为 ;
(5)假如该厂生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水 mL(用100mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH 14-a(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:2013届安徽省高三上学期开学水平检测考试化学试卷(解析版) 题型:填空题
(14分)工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下:
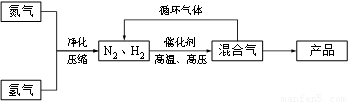
回答下列问题:
(1) 已知: N2(g)
+ O2(g)  2NO(g) ΔH
2NO(g) ΔH +180.5kJ/mol
+180.5kJ/mol
4NH3(g)
+ 5O2(g)  4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH −905kJ/mol
−905kJ/mol
2H2(g)
+ O2(g)  2H2O(g) ΔH
2H2O(g) ΔH −483.6kJ/mol
−483.6kJ/mol
则N2(g)
+ 3H2(g) ≒ 2NH3(g) ΔH  ________________。
________________。
(2) 如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3) 合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤 ②蒸馏 ③渗析 ④萃取
(4) 可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5) 假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江省四校联考一模(理综)化学部分 题型:填空题
[化学——选修化学与技术](15分)
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),其
2NH3(g),其
部分工业流程如下:
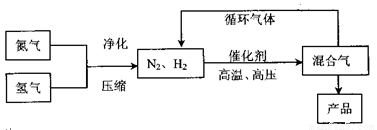
回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+O2(g)=2H2(g) △H=-483.6kJ/mol
则N2(g)+2H2 2NH3(g)的△H=
;
2NH3(g)的△H=
;
(2)如果工业上,在一定温度下,将1.5molN2气体和6molH2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为 。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是 ;
①增大压强 ②增大反应物质的浓度
③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数很小,所以在工业采取气体循环的流程。即反应后通过降低混合气体的温度而使氢气分离出来。这种分离物质的方法其原理类似于下列哪种方
法? (填编号)
①过滤 ②蒸馏 ③渗析 ④萃取
理由是 ;
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为 ;
(5)假如该厂生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水 mL(用100mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH 14-a(填“大于”“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com