
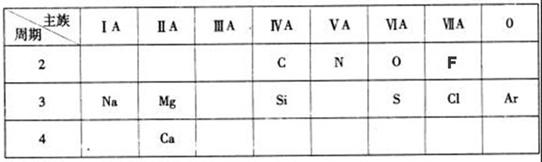
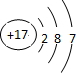 (3)NaOH (4)N (5)元素 (6)弱
(3)NaOH (4)N (5)元素 (6)弱 ;同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。在第三周期中最活泼的金属是Na,所以氢氧化钠的碱性最强,N的原子半径大于O的原子半径;牛奶是混合物,所以“高钙牛奶”中的钙是指元素,而不是单质;同主族元素自上而下非金属性逐渐减弱,金属性逐渐增强,氯化氢的稳定性弱于氟化氢的;常温下为红棕色气体的氧化物的化学式是NO2;电解熔融氯化镁生成物是镁和氯气;S是第ⅥA,最低价是-2价,所以氢化物的化学式为H2S,其中H元素与S元素的质量比是(1×2)︰32=1︰16。
;同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。在第三周期中最活泼的金属是Na,所以氢氧化钠的碱性最强,N的原子半径大于O的原子半径;牛奶是混合物,所以“高钙牛奶”中的钙是指元素,而不是单质;同主族元素自上而下非金属性逐渐减弱,金属性逐渐增强,氯化氢的稳定性弱于氟化氢的;常温下为红棕色气体的氧化物的化学式是NO2;电解熔融氯化镁生成物是镁和氯气;S是第ⅥA,最低价是-2价,所以氢化物的化学式为H2S,其中H元素与S元素的质量比是(1×2)︰32=1︰16。

科目:高中化学 来源:不详 题型:单选题
| A.①②③⑥ | B.②③④ | C.①②③ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X>Y>Z | B.X>Z>Y | C.Y>X>Z | D.Y>Z>X |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔沸点:F2<Cl2<Br2<I2 | B.颜色:F2、Cl2、Br2、I2逐渐加深 |
| C.还原性: F―>Cl―>Br―>I― | D.热稳定性:HF>HCl>HBr>HI |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
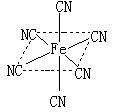
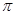 键数目为 ;
键数目为 ;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种粒子,若核外电子排布完全相同,则其化学性质一定相同 |
| B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| C.1molCO和1molCH4分别完全燃烧生成CO2(g)和H2O(l)时,放出的热量依次为283.0kJ和890.3kJ,则相同质量的这两种燃料,完全燃烧放出的热量CH4比CO少 |
| D.不存在两种质子数和电子数均相同的阳离子和阴离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | | | | c | | d | |
| 3 | a | b | | | | e | f |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com